题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素N的基态原子电子排布式 .
(2)元素B、G形成的单质熔点更高的是 (填化学式),原因是
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是 (填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有 (填序号),CS2分子的空间构型是 .
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 .

试回答下列问题:
(1)请写出元素N的基态原子电子排布式
(2)元素B、G形成的单质熔点更高的是
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为
考点:元素周期律和元素周期表的综合应用
专题:
分析:(1)N为27号Co元素,根据核外电子排布规律书写Co基态原子电子排布式;
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高;
(3)根据相似相溶原理解答;
(4)根据价层电子对互斥理论确定其杂化方式;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体.加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,据此书写.
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高;
(3)根据相似相溶原理解答;
(4)根据价层电子对互斥理论确定其杂化方式;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体.加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,据此书写.
解答:
解:(1)N为27号Co元素,Co基态原子电子排布式为1s22s22p63s23p63d74s2,故答案为:1s22s22p63s23p63d74s2;
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高,Li和Na的价电子数相同,晶体中Li+离子半径比Na+小,则金属锂中金属键更强,故Li的熔点更高,
故答案为:Mg;Li;Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高;
(3)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2都是非极性溶剂,根据相似相溶原理,可判断ME2L2是非极性分子,
故答案为:非极性;
(4)①苯中每个碳原子只含3个σ键且没有孤电子对,所以属于sp2杂化;
②CH3OH中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
③HCHO中碳原子含有3个σ键且没有孤电子对,所以属于sp2杂化;
④CS2中碳原子含有2个σ键且没有孤电子对,所以属于sp杂化;
⑤CCl4中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
CS2中碳原子属于sp杂化,其结构为S=C=S,属于直线型分子;
故答案为:①③;直线型;
(5)加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体,加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,故该配合物的结构式为[Co(NH3)5SO4]Br,故答案为:[Co(NH3)5SO4]Br.
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高,Li和Na的价电子数相同,晶体中Li+离子半径比Na+小,则金属锂中金属键更强,故Li的熔点更高,
故答案为:Mg;Li;Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高;
(3)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2都是非极性溶剂,根据相似相溶原理,可判断ME2L2是非极性分子,
故答案为:非极性;
(4)①苯中每个碳原子只含3个σ键且没有孤电子对,所以属于sp2杂化;
②CH3OH中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
③HCHO中碳原子含有3个σ键且没有孤电子对,所以属于sp2杂化;
④CS2中碳原子含有2个σ键且没有孤电子对,所以属于sp杂化;
⑤CCl4中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
CS2中碳原子属于sp杂化,其结构为S=C=S,属于直线型分子;
故答案为:①③;直线型;
(5)加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体,加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,故该配合物的结构式为[Co(NH3)5SO4]Br,故答案为:[Co(NH3)5SO4]Br.
点评:本题考查物质结构知识,知识点较综合,原子杂化方式的判断、原子核外电子排布式的书写等知识点是高考热点,应重点掌握,题目难度中等.

练习册系列答案
相关题目
已知:2NO2(g)
2NO(g)+O2(g)△H<0,下列关于该反应的示意图或描述不正确的是( )
| 催化剂 |
| 加热 |
A、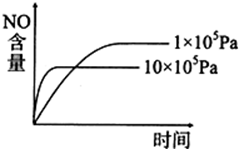 |
B、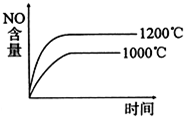 |
| C、NO难溶于水,可以用排水法收集,但不可以用排空气法 |
| D、当生成标准状况下3.36L的氧气时,该反应转移0.6mole |
当可逆反应2SO2+O2?2SO3达到平衡经通入18O2,再次达到平衡时,18O存在于( )
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
生产生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B、工业制备氯气 |
| C、金属冶炼 |
| D、服用含Al(OH)3的胃药可以治疗胃酸过多 |
金属中熔点最低的是( )
| A、Fe | B、Hg | C、Sn | D、Na |
下列有关化学用语使用正确的是( )
A、NH4Br的电子式: | ||
B、S的结构示意图: | ||
| C、乙酸的分子式:CH3COOH | ||
D、原子核内有l8个中子的氯原子:
|
下列物质不能与乙酸反应的是( )
| A、镁 |
| B、CaCl2 |
| C、苛性钠 |
| D、小苏打 |
 锌铜原电池装置如图所示,常常采用电池图式表达式,如:
锌铜原电池装置如图所示,常常采用电池图式表达式,如: “来自石油和煤的两种基本化工原料”A和甲.A是气态烃,甲是液态烃;B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.
“来自石油和煤的两种基本化工原料”A和甲.A是气态烃,甲是液态烃;B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.