题目内容
4.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.供选择的化学试剂及实验方法| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
分析 碘易升华,可加热除去;可用pH试纸测定溶液的酸碱性;乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应;水垢的主要成分为碳酸钙和氢氧化镁,都与酸反应,以此解答.
解答 解:碘易升华,则加热可除去食盐中I2,故选A;
证明某地雨水样品呈酸性,利用pH测定雨水的pH<5.6即可,故选C;
乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,故选D;
水垢的主要成分为碳酸钙和氢氧化镁,都与酸反应,可加入醋酸除去,故选B,
故答案为:
| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
点评 本题考查物质的鉴别和检验以及物质的除杂,为高频考点,把握物质的性质及性质差异为解答的关键,侧重分析及实验能力的考查,题目难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
19.紫薯中含有被誉为“抗癌大王”的硒元素.已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
16.关于0.1mol•L-1 H2SO4溶液的叙述错误的是( )
| A. | 1 L该溶液中含有H2SO4的质量为9.8 g | |
| B. | 将0.1mol H2SO4溶于1L水中可得该溶液 | |
| C. | 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.1 mol•L-1 |
13.关于下列图示的说法中正确的是( )
| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 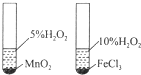 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 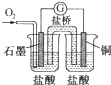 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
14.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是( )
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |
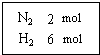 在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:
在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应: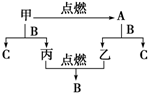 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:

 .
. .
. .
.