题目内容
16.关于0.1mol•L-1 H2SO4溶液的叙述错误的是( )| A. | 1 L该溶液中含有H2SO4的质量为9.8 g | |
| B. | 将0.1mol H2SO4溶于1L水中可得该溶液 | |
| C. | 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.1 mol•L-1 |
分析 A.根据n=cV=$\frac{m}{M}$计算含有硫酸的质量;
B.将0.1mol H2SO4溶于1L水中,所得溶液的体积不是1L;
C.根据c(H+)=2c(H2SO4)进行计算;
D.根据溶液为均一、稳定的分散系进行判断.
解答 解:A.n(H2SO4)=1L×0.1mol/L=0.1mol,m(H2SO4)=0.1mol×98g.mol=9.8g,故A正确;
B.将0.1mol H2SO4溶于1L水中,所得溶液的体积不是1L,则溶液浓度不是0.1mol/L,故B错误;
C.溶液具有均一性,则取出的0.5L溶液中氢离子浓度为:c(H+)=2c(H2SO4)=2×0.1mol/L=0.2mol/L,故C正确;
D.溶液为均一、稳定的分散系,从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度应为0.1mol/L,故D正确;
故选B.
点评 本题考查物质的量浓度的相关计算,为高频考点,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
4.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.供选择的化学试剂及实验方法
A.加热升华
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
11.生活中的一些问题常涉及到化学知识,则下列叙述正确的是( )
| A. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
1.化学与社会、生活、环境密切相关.下列有关说法不正确的是( )
| A. | 酒精、汽油都是有机溶剂,可以清洗衣服上的油污斑点 | |
| B. | 硫酸可以作铅蓄电池的电解质,也可用于溶解除去锅炉和水壶里的水垢 | |
| C. | 废旧塑料制品、废旧金属制品要回收和利用 | |
| D. | 推广太阳能、风能等新能源技术是施行低碳经济的有效途径 |
8.一种直接肼燃料电池的结构如图所示,下列说法正确的是( )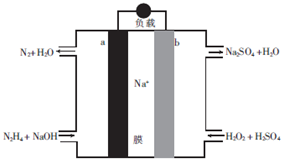

| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
5.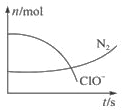 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3 mol ClO-参加反应时,则有1 mol N2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5 mol ClO-参加反应时,则有1 mol N2生成 | |
| D. | 若生成2.24 L N2,则转移电子0.6 mol |
6.根据下表所示化学反应与数据关系:
请回答:
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
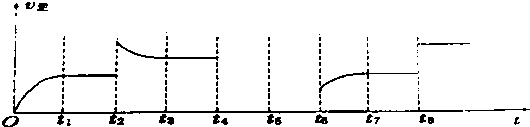
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
 B.
B. C.
C. .
.