题目内容
15.在标准状况下,CO和CO2的混合气体质量为 36g,体积为 22.4L,则CO所占的体积是11.2L,质量是14g.分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令混合气体中CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与物质的量之和列放出计算x、y的值,再根据V=nVm计算CO的体积,根据m=nM计算CO的质量,由此分析解答.
解答 解:标准状况下,混合气体的物质的量为$\frac{22.4L}{22.4L/mol\\;}$=1mol,
令混合气体中CO和CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=1}\\{28x+44y=36}\end{array}\right.$,解得x=0.5,y=0.5;
故CO的体积为0.5mol×22.4L/mol=11.2L,质量为0.5mol×28g/mol=14g,
故答案为:11.2;14.
点评 本题考查混合物的有关计算、常用化学计量的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
6.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
3.下列说法正确的是( )
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
10.结合如图判断,下列叙述正确的是( )
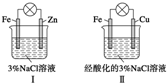

| A. | Ⅰ中不能形成原电池 | |
| B. | Ⅱ中负极反应是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正极反应是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀 |
4.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.供选择的化学试剂及实验方法
A.加热升华
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
5.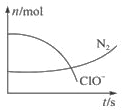 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3 mol ClO-参加反应时,则有1 mol N2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5 mol ClO-参加反应时,则有1 mol N2生成 | |
| D. | 若生成2.24 L N2,则转移电子0.6 mol |
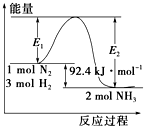 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题. B.
B. C.
C. .
.