题目内容
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 用亚硫酸溶液无法制取硫酸溶液 |
| B | 升高温度,反应速率越快 | 常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C | 金属越活泼,其阳离子氧化性越弱 | Fe3+的氧化性弱于Cu2+ |
| D | Ksp小的沉淀易向Ksp更小的沉淀转化 | CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
| A、A | B、B | C、C | D、D |
考点:化学反应的基本原理
专题:基本概念与基本理论,元素及其化合物
分析:A.亚硫酸和氯气在水溶液中反应生成硫酸和盐酸;
B.钠与氧气的反应,与速率无关,取决于温度;
C.金属越活泼,其阳离子氧化性越弱,Fe2+的氧化性弱于Cu2+;
D.从难溶电解质的溶解平衡的角度分析.
B.钠与氧气的反应,与速率无关,取决于温度;
C.金属越活泼,其阳离子氧化性越弱,Fe2+的氧化性弱于Cu2+;
D.从难溶电解质的溶解平衡的角度分析.
解答:
解:A、亚硫酸和氯气在水溶液中反应生成硫酸和盐酸,反应的离子方程式为:H2SO3+Cl2+H2O═4H++2Cl-+SO42-,故A错误;
B、钠在常温时与氧气反应生成氧化钠,加热时生成过氧化钠,速率无关,故B错误;
C、金属越活泼,其阳离子氧化性越弱,Fe2+的氧化性弱于Cu2+,故C错误;
D、CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀,原因是:Ksp小的沉淀易向Ksp更小的沉淀转化,故D正确,故选D.
B、钠在常温时与氧气反应生成氧化钠,加热时生成过氧化钠,速率无关,故B错误;
C、金属越活泼,其阳离子氧化性越弱,Fe2+的氧化性弱于Cu2+,故C错误;
D、CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀,原因是:Ksp小的沉淀易向Ksp更小的沉淀转化,故D正确,故选D.
点评:本题考查较为综合,为高频考点,侧重学生的分析能力的考查,注意把握物质的性质,易错点为C,注意把握二者沸点的差异,难度中等.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |
pH=2的醋酸溶液1L,说法正确的是( )
| A、加入足量的Zn粒,产生标况下112mLH2 |
| B、加入NaOH固体后醋酸电离平衡右移,pH减小 |
| C、与一定量盐酸混合后pH=1,此时c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/L |
| D、加入冰醋酸,电离程度增大,pH减小 |
以下说法正确的是( )
| A、少量的金属钠长期暴露在空气中,它的最终产物是NaHCO3 |
| B、向紫色石蕊溶液中加入过量Na2O2粉末,振荡,产生气泡,溶液仍为紫色 |
| C、CO与H2混合气体3 g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为3g |
| D、将1g Na2CO3和NaHCO3分别溶于10mL水中,滴入酚酞试液后溶液所显红色深浅相同 |
下列有关物质性质的应用错误的是( )
| A、二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸 |
| B、碳酸氢钠具有弱酸性,可用于食品发酵 |
| C、次氯酸钠具有强氧化性,可用于配制消毒液 |
| D、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
下列说法中,不正确的是( )
A、按系统命名法,化合物 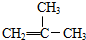 的名称为:2-甲基丙烯 的名称为:2-甲基丙烯 |
| B、具有手性异构的两个物质,性质上有较大的差别 |
C、如图所示的化合物是苯的同系物 |
| D、烯烃和甲苯都可以使酸性高锰酸钾溶液褪色 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: