题目内容
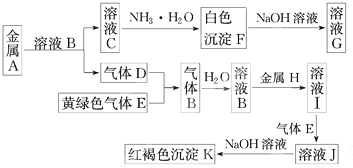
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-.现取该溶液进行有关实验,实验结果如图所示:
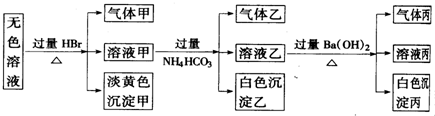
(1)沉淀甲是 ,生成甲的离子方程式为 .
(2)沉淀乙是 ,由溶液甲生成乙的离子方程式为 .
(3)沉淀丙是 ,用化学方法确定其成分 .
(4)气体甲成分可能有几种 .
(5)肯定存在的离子有 ; 一定不存在 .

(1)沉淀甲是
(2)沉淀乙是
(3)沉淀丙是
(4)气体甲成分可能有几种
(5)肯定存在的离子有
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,然后结合离子的共存来分析.
解答:
解:由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,Ag+、Ba2+、Al3+与S2-、SO32-不能共存,则不存在,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO32-、AlO2-,
(1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,故答案为:S;2S2-+SO32-+6H+=3S↓+3H2O;
(2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4,若全部溶解,则仅有BaCO3;
(4)根据以上分析可知,气体甲可能为二氧化碳和二氧化硫以及硫化氢的混合物,故答案为:H2S或SO2或CO2;
(5)肯定存在的离子有Na+、S2-、SO32-、AlO2-,故答案为:Na+、S2-、SO32-、AlO2-.
(1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,故答案为:S;2S2-+SO32-+6H+=3S↓+3H2O;
(2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4,若全部溶解,则仅有BaCO3;
(4)根据以上分析可知,气体甲可能为二氧化碳和二氧化硫以及硫化氢的混合物,故答案为:H2S或SO2或CO2;
(5)肯定存在的离子有Na+、S2-、SO32-、AlO2-,故答案为:Na+、S2-、SO32-、AlO2-.
点评:本题考查离子的共存及离子反应,利用流程及离子之间的反应推断出存在离子是解答的关键,注意过量离子及电荷守恒的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
现有铜质印刷线路板浸入200 mL氯化铁溶液中,有6.4g铜被腐蚀掉.取出印刷线路板,向溶液中加入5.6 g铁粉,经充分反应后,溶液中还存在3.2g不溶物.下列说法正确的是( )
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |
下列有关实验装置正确的是( )
A、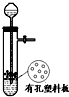 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、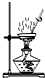 用于灼烧Al(OH)3 |
C、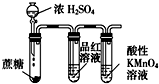 用于检验浓硫酸与蔗糖反应产生的二氧化硫 |
D、 由于实验室制备乙酸乙酯 |
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3?L-3,MgF2的Ksp为7.4×10-11mol3?L-3.下列说法中正确的是( )
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
常温下在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、中性溶液:Cu2+、Al3+、NO3-、SO42- |
| B、加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3- |
| C、加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、常温下,c(H+)/c(OH-)=1×1012的溶液:K+、AlO2-、CO32-、Na+ |
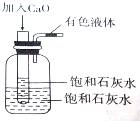 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.