题目内容
下列有关说法正确的是( )
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |
考点:金属的电化学腐蚀与防护,反应热和焓变
专题:基本概念与基本理论
分析:A、从电解质是酸性的角度来分析;
B、根据吉布斯自由能来判断;
C、只要使钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可转化;
D、CH3COOH溶液加水稀释,根据电离平衡的移动来分析.
B、根据吉布斯自由能来判断;
C、只要使钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可转化;
D、CH3COOH溶液加水稀释,根据电离平衡的移动来分析.
解答:
解:A、钢铁腐蚀时若介质为酸性,则可能同时发生析氢腐蚀与吸氧腐蚀,故A错误;
B、该反应熵变大于零,在室温下不能自发进行,则焓变一定大于零,故B正确;
C、可以用高浓度的碳酸盐溶液使溶液中钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可使BaSO4沉淀转化为BaCO3沉淀,故C错误;
D、加水稀释,平衡中醋酸分子浓度c(CH3COOH)和c(H+)均变小,水的离子积Kw不变,故c(OH-)增大,从而c(OH-)/c(CH3COOH)增大,D正确;
故选BD.
B、该反应熵变大于零,在室温下不能自发进行,则焓变一定大于零,故B正确;
C、可以用高浓度的碳酸盐溶液使溶液中钡离子和碳酸根离子浓度积大于Ksp(BaCO3),即可使BaSO4沉淀转化为BaCO3沉淀,故C错误;
D、加水稀释,平衡中醋酸分子浓度c(CH3COOH)和c(H+)均变小,水的离子积Kw不变,故c(OH-)增大,从而c(OH-)/c(CH3COOH)增大,D正确;
故选BD.
点评:本题综合考察了钢铁的腐蚀、反应能否自发的判断、沉淀溶解平衡和电离平衡的应用,综合性较强,难度适中.

练习册系列答案
相关题目
用鲍林的杂化轨道理论解释甲烷分子的正四面体结构,下列说法不正确的是( )
| A、C原子的四个杂化轨道的能量一样 |
| B、C原子的sp3杂化轨道之间夹角一样 |
| C、C原子有1个sp3杂化轨道由孤电子对占据 |
| D、C原子的4个价电子分别占据4个sp3杂化轨道 |
在1L密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ?mol-1(Q>O),容器内部分物质的物质的量浓度如下表:下列说法错误的是( )
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L?min) |
| B、反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4 min时、第8 min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2 min内,该反应的放出0.05Q kJ的热量 |

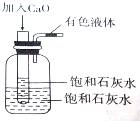 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.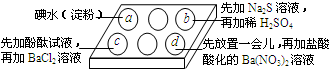 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )