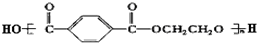
题目内容
以下说法正确的是( )
| A、少量的金属钠长期暴露在空气中,它的最终产物是NaHCO3 |
| B、向紫色石蕊溶液中加入过量Na2O2粉末,振荡,产生气泡,溶液仍为紫色 |
| C、CO与H2混合气体3 g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为3g |
| D、将1g Na2CO3和NaHCO3分别溶于10mL水中,滴入酚酞试液后溶液所显红色深浅相同 |
考点:钠的重要化合物,钠的化学性质
专题:
分析:A.钠长期暴露在空气中,它的最终产物是Na2CO3;
B.过氧化钠有强氧化性;
C.利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;
D.相同浓度时Na2CO3水解程度大,碱性强.
B.过氧化钠有强氧化性;
C.利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
| ||
| ||
D.相同浓度时Na2CO3水解程度大,碱性强.
解答:
解:A.钠长期暴露在空气中,钠氧气反应生成氧化钠,氧化钠和水反应生成氢氧化钠,氢氧化钠易潮解,氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠会从溶液中析出生成十水碳酸钠,十水碳酸钠失水生成碳酸钠,它的最终产物是Na2CO3,故B错误;
B.过氧化钠有强氧化性,能将石蕊氧化为无色物质,故B错误;
C.CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;所以Na2O2增重的质量为CO与H2混合气体的质量,共3g,故C正确;
D.相同浓度时Na2CO3水解程度大,碱性强,则滴加酚酞试液后,Na2CO3溶液颜色比较深,故D错误;
故选C.
B.过氧化钠有强氧化性,能将石蕊氧化为无色物质,故B错误;
C.CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
| ||
2H2+O2
| ||
D.相同浓度时Na2CO3水解程度大,碱性强,则滴加酚酞试液后,Na2CO3溶液颜色比较深,故D错误;
故选C.
点评:本题考查钠在空气中的变化、强氧化剂、有关过氧化钠增重问题的讨论意见碳酸钠与碳酸氢钠的区别等,难度不大,注意过氧化钠有强氧化性,能将石蕊氧化为无色物质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有铜质印刷线路板浸入200 mL氯化铁溶液中,有6.4g铜被腐蚀掉.取出印刷线路板,向溶液中加入5.6 g铁粉,经充分反应后,溶液中还存在3.2g不溶物.下列说法正确的是( )
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3?L-3,MgF2的Ksp为7.4×10-11mol3?L-3.下列说法中正确的是( )
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
空气是人类生存所必需的重要资源.为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不利于“蓝天工程”建设的是( )
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、采用“绿色化学”工艺,使原料尽可能转化为所需要的物质,减少废气排放 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |
常温下在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、中性溶液:Cu2+、Al3+、NO3-、SO42- |
| B、加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3- |
| C、加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、常温下,c(H+)/c(OH-)=1×1012的溶液:K+、AlO2-、CO32-、Na+ |
提纯分离下述物质时,采用的方法与制取无水乙醇的方法相同的是( )
| A、分离硬脂酸和甘油 |
| B、除去乙醛中少量醋酸 |
| C、分离苯酚和苯 |
| D、分离乙烷和乙醇 |
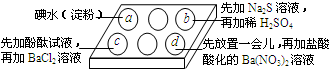 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )