题目内容
pH=2的醋酸溶液1L,说法正确的是( )
| A、加入足量的Zn粒,产生标况下112mLH2 |
| B、加入NaOH固体后醋酸电离平衡右移,pH减小 |
| C、与一定量盐酸混合后pH=1,此时c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/L |
| D、加入冰醋酸,电离程度增大,pH减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸中存在电离平衡CH3COOH?CH3COO-+H+,
A、加入足量的Zn粒,醋酸完全反应,不知道此时的电离度,所以不法求醋酸的物质的量浓度;
B、加入NaOH固体后醋酸电离平衡右移,氢离子浓度减小,pH增大;
C、根据电荷守恒,可知c(CH3COO-)+c(Cl-)+c(OH-)=c(H+);
D、加入冰醋酸,浓度越大电离程度越小,氢离子浓度变大,pH减小.
A、加入足量的Zn粒,醋酸完全反应,不知道此时的电离度,所以不法求醋酸的物质的量浓度;
B、加入NaOH固体后醋酸电离平衡右移,氢离子浓度减小,pH增大;
C、根据电荷守恒,可知c(CH3COO-)+c(Cl-)+c(OH-)=c(H+);
D、加入冰醋酸,浓度越大电离程度越小,氢离子浓度变大,pH减小.
解答:
解:A、加入足量的Zn粒,醋酸完全反应,不知道此时的电离度,所以不法求醋酸的物质的量浓度,所以无法求产生氢气的体积,故A错误;
B、加入NaOH固体后醋酸电离平衡右移,氢离子浓度减小,pH增大,故B错误;
C、根据电荷守恒,可知c(CH3COO-)+c(Cl-)+c(OH-)=c(H+),而pH=1,所以c(H+)=0.1mol/L,即c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/L,故C正确;
D、加入冰醋酸,浓度越大电离程度越小,氢离子浓度变大,pH减小,故D错误;
故选C.
B、加入NaOH固体后醋酸电离平衡右移,氢离子浓度减小,pH增大,故B错误;
C、根据电荷守恒,可知c(CH3COO-)+c(Cl-)+c(OH-)=c(H+),而pH=1,所以c(H+)=0.1mol/L,即c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/L,故C正确;
D、加入冰醋酸,浓度越大电离程度越小,氢离子浓度变大,pH减小,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意醋酸浓度增大,醋酸电离度减小,但氢离子浓度增大,题目难度不大.

练习册系列答案
相关题目
在1L密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ?mol-1(Q>O),容器内部分物质的物质的量浓度如下表:下列说法错误的是( )
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L?min) |
| B、反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4 min时、第8 min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2 min内,该反应的放出0.05Q kJ的热量 |
下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
A、 除去CO气体中的CO2气体 |
B、 向容量瓶中转移液体 |
C、 托盘天平称氢氧化钠固体质量 |
D、 分离互不相溶的两种液体 |
下列有关实验装置正确的是( )
A、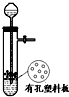 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、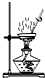 用于灼烧Al(OH)3 |
C、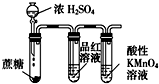 用于检验浓硫酸与蔗糖反应产生的二氧化硫 |
D、 由于实验室制备乙酸乙酯 |
为防止有机物挥发,可加一层水保存,即水封.下列有机物中,既能用水封法保存,又能发生水解和消去反应的是( )
| A、乙醇 | B、一溴乙烷 |
| C、乙酸乙酯 | D、四氯化碳 |
下列叙述中,不正确的是( )
| A、玻璃、水泥、陶瓷都是硅酸盐产品 |
| B、水晶、玛瑙的主要成分都是SiO2 |
| C、硅元素在地壳中含量最多 |
| D、二氧化硅和大多数硅酸盐的化学性质都很稳定 |
下列化合物中同分异构体数目最少的是( )
| A、C5H10 |
| B、C6H14 |
| C、C4H9Cl |
| D、C4H10O |