题目内容
能正确表示下列反应的离子方程式是( )
| A、少量金属钠放入冷水中 Na+2H2O=Na++2OH-+H2↑ |
| B、水溶液中NaHCO3的电离:HCO3-?CO32-+H+ |
| C、碳酸氢铵溶液和氢氧化钠溶液等物质的量浓度、等体积混合 NH4++OH-═NH3?H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
考点:离子方程式的书写
专题:
分析:A.根据电荷守恒判断,离子方程式两边正电荷不相等;
B.碳酸氢钠为强电解质,溶液中电离出钠离子、碳酸氢根离子;
C.氢离子结合氢氧根离子能力大于铵根离子,氢离子优先与氢氧根离子反应;
D.硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀.
B.碳酸氢钠为强电解质,溶液中电离出钠离子、碳酸氢根离子;
C.氢离子结合氢氧根离子能力大于铵根离子,氢离子优先与氢氧根离子反应;
D.硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀.
解答:
解:A.少量金属钠放入冷水中,反应生成氢氧化钠 和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.碳酸氢钠在溶液中电离出钠离子和碳酸氢根离子,电离方程式用等号,正确电离方程式为:NaHCO3=HCO3-+Na+,故B错误;
C.碳酸氢铵溶液和氢氧化钠溶液等物质的量浓度、等体积混合,氢氧化钠不足,氢离子优先与氢氧根离子反应,正确的离子方程式为:H++OH-═H2O,故C错误;
D.硫酸铜溶液和氢氧化钡溶液混合,反应生成硫酸钡和氢氧化铜,反应的离子方程式为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
B.碳酸氢钠在溶液中电离出钠离子和碳酸氢根离子,电离方程式用等号,正确电离方程式为:NaHCO3=HCO3-+Na+,故B错误;
C.碳酸氢铵溶液和氢氧化钠溶液等物质的量浓度、等体积混合,氢氧化钠不足,氢离子优先与氢氧根离子反应,正确的离子方程式为:H++OH-═H2O,故C错误;
D.硫酸铜溶液和氢氧化钡溶液混合,反应生成硫酸钡和氢氧化铜,反应的离子方程式为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
点评:本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
在4NH3+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH3)=0.8mol/(L?s) |
| B、υ(O2)=1.0mol/(L?s) |
| C、υ(NO)=1.0mol/(L?s) |
| D、υ(H2O)=1.8mol/(L?s) |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、25℃和101KPa的条件下,4.9LCH4完全燃烧生成的H2O的分子数为0.4NA |
| B、1molNH3中含有3NA对电子对 |
| C、Na2O2与H2O反应生成标准状况下11.2 L O2时,转移的电子数为2NA |
| D、标准状况下,2.24L HF中所含电子数为NA |
下列离子方程式正确的是( )
| A、已知H2SO3的Ka1大于HClO的Ka NaClO+H2O+SO2═Na2SO3+HClO | ||||
| B、碳酸氢钠水解 HCO3-+H2O?H3O++CO32- | ||||
C、实验室制备氢氧化铁胶体 Fe3++3H2O
| ||||
| D、向NaHSO4溶液中加入Ba(OH)2溶液至刚好呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
下列物质中,导电性能最差的是( )
| A、石墨棒 |
| B、HCl溶液 |
| C、熔融的氢氧化钾 |
| D、固体氯化钾 |
下列各图所表示的反应属于放出热量的是( )
A、 |
B、 |
C、 |
D、 |
下列化学用语和描述均正确的是( )
A、结构示意图为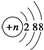 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为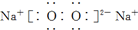 和 和 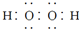 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |