题目内容
下列物质中,导电性能最差的是( )
| A、石墨棒 |
| B、HCl溶液 |
| C、熔融的氢氧化钾 |
| D、固体氯化钾 |
考点:电解质溶液的导电性
专题:
分析:含有自由移动离子或自由移动电子的物质能导电,离子浓度与导电性成正比,所以离子浓度越大其导电性越强,据此分析解答.
解答:
解:含有自由移动离子或自由移动电子的物质能导电,离子浓度与导电性成正比,所以离子浓度越大其导电性越强,
A.石墨棒属于导体能导电,导电性较好,故A不选;
B.HCl溶液中含有自由移动的离子,所以能导电,导电性较好,故B不选;
C.熔融KOH中含有自由移动的离子,所以能导电,导电性较好,故C不选;
D.固体KCl中不含自由移动的离子或自由移动的电子,所以不导电,导电性最差,故D选;
故选D.
A.石墨棒属于导体能导电,导电性较好,故A不选;
B.HCl溶液中含有自由移动的离子,所以能导电,导电性较好,故B不选;
C.熔融KOH中含有自由移动的离子,所以能导电,导电性较好,故C不选;
D.固体KCl中不含自由移动的离子或自由移动的电子,所以不导电,导电性最差,故D选;
故选D.
点评:本题考查物质的导电性强弱判断,知道导电性与离子浓度或自由电子有关,与电解质强弱无关,为易错题.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
化学在工业生产和日常生活中有着重要的应用.下列说法正确的是( )
| A、陶瓷、水泥和光导纤维均属于硅酸盐材料 |
| B、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C、常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D、NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、28 g乙烯和28g丙烯中均含有6NA对共用电子对 |
| B、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、在1L浓度为0.1mol?L-的NaCO3溶液中所含阴离子数为0.1 NA |
只能表示一个化学反应的离子方程式的是( )
| A、Cu(OH)2+2HCl═CuCl2+2H2O Cu(OH)2+2H+═Cu2++2H2O |
| B、FeSO4+Ba(OH)2═Fe(OH)2↓+BaSO4↓ Fe2++SO42-+Ba2++2OH-═Fe(OH)2↓+BaSO4↓ |
| C、Ba(OH)2+H2SO4═BaSO4↓+2H2O Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、2HCl+Fe(OH)2═Fe2++2H2O 2H++Fe(OH)2═Fe2++2H2O |
能正确表示下列反应的离子方程式是( )
| A、少量金属钠放入冷水中 Na+2H2O=Na++2OH-+H2↑ |
| B、水溶液中NaHCO3的电离:HCO3-?CO32-+H+ |
| C、碳酸氢铵溶液和氢氧化钠溶液等物质的量浓度、等体积混合 NH4++OH-═NH3?H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
下列关于燃烧热的说法中正确的是( )
A、 |
B、 |
C、 |
D、 |
向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
| A、蒸馏水 |
| B、0.5 mol?L-1硫酸镁溶液 |
| C、0.5 mol?L-1氯化钾溶液 |
| D、0.5 mol?L-1盐酸 |
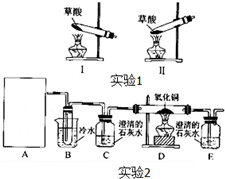 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.