题目内容
17.有四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,B原子的质子数与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:(1)A、B、C、D的元素符号分别为H、O、Na、K.
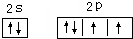
(2)B2-的电子式为
 ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.(3)写出与C+具有相同电子数的五种分子(化学式):CH4、NH3、H2O、HF、Ar.
分析 四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,则B为O、C为Na;B原子的质子数与C原子的质子数之和等于D原子的质子数,则D的质子数=8+11=19,故D为K元素,A原子失去1个电子后变成一个质子,则A为H元素,以此解答该题.
解答 解:有四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,则B为O、C为Na;B原子的质子数与C原子的质子数之和等于D原子的质子数,则D的质子数=8+11=19,故D为K元素,A原子失去1个电子后变成一个质子,则A为H元素,
(1)由上述分析可知,A、B、C、D的分别是H、O、Na、K,故答案为:H;O;Na;K;
(2)O2-的电子式为 ;K原子核外电子数为19,根据能量最低原理,其原子结构示意图为
;K原子核外电子数为19,根据能量最低原理,其原子结构示意图为 ,Na+离子的结构示意图为
,Na+离子的结构示意图为 ,故答案为:
,故答案为: ;
; ;
; ;
;
(3)与C+具有相同电子数的五种分子分别为CH4、NH3、H2O、HF、Ar,故答案为:CH4;NH3;H2O;HF;Ar.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、10电子微粒为解答的关键,侧重分析与应用能力的考查,注意化学用语的应用,题目难度不大.

练习册系列答案
相关题目
5.如图是MgSO4、NaCl的溶解度曲线.下列说法正确的是( )


| A. | MgSO4的溶解度随温度升高而升高 | |
| B. | NaCl的溶解度比MgSO4的溶解度大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
12.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-48.40 kJ•mol-1 |
2.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | FeCl3溶液 | D. | NaCl溶液 |
6.重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程如图所示.下列分析错误的是( )
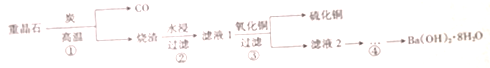

| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
7.向FeI2和FeBr2物质的量之比为2:3的混合溶液中逐滴滴入氯水,下列离子反应可能发生的是( )
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
 ;
; (用元素符号表示).
(用元素符号表示).
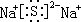 .
.