题目内容
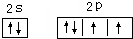
7.现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:(1)请写出:D基态原子的价层电子排图:
 ;
;F 基态原子的外围电子排布式:3d104s1.
(2)下列说法错误的是AD.
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2.
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似.
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键.
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为
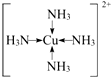 (用元素符号表示).
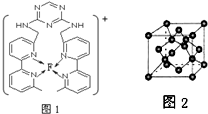
(用元素符号表示).(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有sp2、sp3.
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为8.
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}$.
分析 A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,则A为H元素;B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,故F为Cu,以此解答该题.
解答 解:A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,故F为Cu,(3)中C与A形成的气体X,则A为H元素,X为NH3,
(1)D为O元素,基态原子的价层电子排布图: ;F为Cu元素,基态原子的外围电子排布式为:3d104s1,
;F为Cu元素,基态原子的外围电子排布式为:3d104s1,
故答案为: ;3d104s1;
;3d104s1;
(2)A.沸点:SiO2>CO2,是由于二氧化硅属于原子晶体,二氧化碳形成分子晶体,故A错误;
B.同周期随原子序数增大电负性增大,故电负性顺序:C<N<O,故B正确;
C.N2与CO分子都含有2个原子、价电子总数都是10,二者为等电子体,结构相似,故C正确;
D.稳定性:H2O>H2S,是因为非金属性O>S,与分子之间存在氢键无关,故D错误,
故答案为:AD;
(3)C与A形成的气体X,则A为H元素,X为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,该离子的结构式为: ,
,
故答案为: ;
;
(4)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2、sp3;
(5)由B单质的一种同素异形体的晶胞结构可知,B原子有4个位于晶胞内部,其余B原子位于定点、面心,则一个晶胞中所含B原子数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,
故答案为:8;
(6)O与Cu形成离子个数比为1:1的化合物为CuO,晶胞与NaCl类似,其晶胞结构为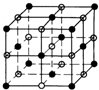 ,晶胞中铜离子数目=阳离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O2-离子的半径为a pm,Cu2+离子的半径b pm,则晶胞中原子总体积=4×($\frac{4}{3}$πa3+$\frac{4}{3}$πb3)pm3,晶胞棱长=2(a+b)pm,故晶胞体积=8(a+b)3pm3,故该晶胞的空间利用率=$\frac{4×(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})p{m}^{3}}{8(a+b)^{3}p{m}^{3}}$=$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}$,
,晶胞中铜离子数目=阳离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O2-离子的半径为a pm,Cu2+离子的半径b pm,则晶胞中原子总体积=4×($\frac{4}{3}$πa3+$\frac{4}{3}$πb3)pm3,晶胞棱长=2(a+b)pm,故晶胞体积=8(a+b)3pm3,故该晶胞的空间利用率=$\frac{4×(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})p{m}^{3}}{8(a+b)^{3}p{m}^{3}}$=$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}$,
故答案为:$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}$;
点评 本题主要考查物质的结构与性质,涉及核外电子排布、电负性、等电子体、晶体类型与性质、配合物、杂化理论、晶胞计算等,难点是晶胞的计算,明确各个字母的含义,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 32g氧气所含原子数目为2NA | |
| B. | 在常温常压下,11.2L氯气含有的分子数为0.5NA | |
| C. | 氯化氢的摩尔质量为36.5g | |
| D. | 在标准状况下,22.4L水的物质的量是1mol |
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
| A. | 用肥皂洗涤久置石灰水的试剂瓶 | B. | 用酒精清洗残留碘的试管 | ||
| C. | 用洗涤剂清洗餐具上的油污 | D. | 用汽油清洗沾在手上的油漆 |
| A. | 在25℃和80℃时纯水中的c(H+)浓度 | |
| B. | 室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4)2CO3 (aq)的c(NH4+) | |
| C. | 25℃时,pH均为3的HCl和NH4Cl溶液中水的电离程度 | |
| D. | 1 L饱和氯化铵溶液中NH4+ 和Cl- 的个数 |
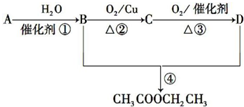 已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.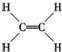 .
.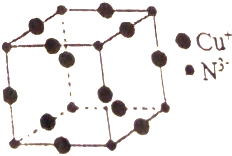 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.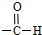 )碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.
)碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.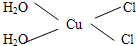 .
. ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.