题目内容
7.向FeI2和FeBr2物质的量之比为2:3的混合溶液中逐滴滴入氯水,下列离子反应可能发生的是( )| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
分析 Cl2既可氧化I-为I2,也可氧化Br-为Br2,也可氧化Fe2+为Fe3+,因还原性I->Fe2+>Br-,所以通入氯气,首先氧化I-,然后氧化Fe2+,最后氧化Br-,据此分析解答.
解答 解:氧化还原反应中:氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,因还原性I->Fe2+>Br-,所以通入氯气,首先氧化I-,然后氧化Fe2+,最后氧化Br-,
A.通入氯气后,可能I-全部被氧化,Fe2+全部被氧化,而溴离子部分氧化,可能发生10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl-,故A正确;
B.通入氯气后,可能I-全部被氧化,Fe2+部分被氧化,发生2Fe2++2I-+2Cl2→2Fe3++I2+4Cl-,故B正确;
C.若6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl-发生反应,说明FeI2的物质的量为2mol,则FeBr2物质的量为4mol,故C错误;
D.若6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl-发生反应,则I-、Fe2+全部被氧化,说明FeI2的物质的量为1mol,则FeBr2物质的量为5mol,故D错误;
故选AB.
点评 本题考查氧化还原反应,清楚还原性I->Fe2+>Br-以及溶液中离子应的先后顺序是解题的关键,题目难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
15.科研、生产、生活中离不开溶液的浓度,相关物质的浓度描述可信的是( )
| A. | 5mol/L 氢硫酸溶液 | B. | 18.4mol/L 盐酸溶液 | ||
| C. | 含甲醛40%的福尔马林溶液 | D. | 含乙酸12%的食醋溶液 |
2.化学方程式是一种重要的化学用语.所写的化学方程式不能用来正确解释化学过程或事实的是( )
| A. | 熔融烧碱时不能使用石英坩埚:SiO2+2NaOH$\stackrel{△}{→}$ Na2SiO3+H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+→I2+O2↑+4H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) $\stackrel{高温}{→}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+→Cl2↑+H2O |
12.下列说法中正确的是( )
| A. | 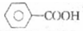 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 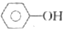 和 和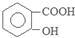 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
19.NA代表阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
16.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
17.铝是金属元素,某同学认为铝也有一定的非金属性.能支持该观点的下列描述是( )
| A. | 氢氧化铝能溶于强碱溶液 | B. | 铝片能与盐酸反应生成氢气 | ||
| C. | 氯化铝溶液显酸性 | D. | 铝能发生铝热反应 |
 ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.
 .
.