题目内容
18.我们中学阶段接触过许多盐,盐是一类重要的物质.按要求回答下列问题:(1)与酸或碱反应是盐的通性.有两种盐,它们均由位于元素周期表前两周期相同的四种元素组成,且它们既可以和强酸反应,又可以和强碱反应,则这两种盐的化学式分别为NH4HCO3、(NH4)2CO3.
(2)KAl(SO4)2是一种复盐,假设1molKAl(SO4)2完全转化为Al(OH)3胶体,则分散系中胶体微粒数小于(填“大小”、“小于”或“等于”)NA(NA表示阿伏加德罗常数的值),胶体的微粒直径大小介于1-100nm之间;如果向含1molKAl(SO4)2的溶液中加入1mol•L-1的Ba(OH)2溶液,当生成沉淀的物质的量最大时,加入的体积为1.5L.
(3)KMnO4是一种常用的氧化剂,在酸性的条件下氧化能力更强,酸化时一般用稀硫酸,而不用盐酸,其原因是(用离子方程式表示)2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;也不用稀硝酸,其原因是稀硝酸也具有氧化性.
(4)Na2CO3是一种重要的工业用碱.向一定量的Na2CO3溶液中缓慢滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中各离子数目也相应地发生变化.如果不考虑水的电离,在加入盐酸的过程中,离子数目一直不变的是Na+(填离子符号,下同),一直减少的是CO32-,一直增大的是Cl-,先增大后减小的是HCO3-.
分析 (1)有两种盐,它们均由位于元素周期表前两周期相同的四种元素组成,且它们既可以和强酸反应,又可以和强碱反应,形成的盐可以是碳酸氢铵和碳酸氨;
(2)胶体微粒是氢氧化铝的集合体,微粒直径在1nm-100nm间,1mol KAl(SO4)2含有1molAl3+,2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,判断Al3+完全沉淀后再滴加Ba(OH)2溶液沉淀量的物质的量变化,确定沉淀量最大时发生的反应,注意此时钡离子与氢氧根离子为1:2;
(3)高锰酸钾能氧化盐酸稀硝酸具有强氧化性;
(4)根据向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,则Na+数目不发生变化,氯离子的数目在增加,碳酸根离子的数目一直在减少,直到为0,碳酸氢根离子的数目先增大后减小,直到为0,据此分析对应的离子.
解答 解:(1)有两种盐,它们均由位于元素周期表前两周期相同的四种元素组成,且它们既可以和强酸反应,又可以和强碱反应,形成的盐可以是碳酸氢铵和碳酸氨,
故答案为:NH4HCO3;(NH4)2CO3;
(2)KAl(SO4)2是一种复盐,假设1molKAl(SO4)2完全转化为Al(OH)3胶体,氢氧化铝胶体微粒是氢氧化铝的集合体,则分散系中胶体微粒数小于1mol,
即微粒数小于NA,胶体的微粒直径大小介于1nm-100nm,
1mol KAl(SO4)2含有1molAl3+、2molSO42-,
开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,
由方程式可知当加入1.5molBa(OH)2时,Al3+完全沉淀,SO42-反应1.5mol,SO42-有剩余,再继续滴加Ba(OH)2溶液,
发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4,
由方程式可知加入1molBa(OH)2,溶解2molA1(OH)3,生成1molBaSO4,
沉淀的物质的量减少,故当Al3+恰好沉淀时,生成的沉淀的物质的量最大,此时加入1.5molBa(OH)2,溶液体积V=$\frac{1.5mol}{1mol/L}$=1.5L,
故答案为:小于;1-100;1.5;
(3)KMnO4是一种常用的氧化剂,在酸性的条件下氧化能力更强,酸化时一般用稀硫酸,而不用盐酸,其原因是氯离子具有还原性,易被高锰酸钾溶液氧化,反应的离子方程式为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,稀硝酸也具有氧化性,一般用硫酸酸化,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;稀硝酸也具有氧化性;
(4)向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,
则Na+的数目不变,即图中a为Na+离子,
碳酸根离子在减少,直至为0,即图中b为CO32-离子,
碳酸氢根离子先增大后减小,直至为0,即图中c为HCO3-离子,
氯离子先为0,随盐酸的加入氯离子的数目在增多,
故答案为:Na+;CO32-;Cl-;HCO3-.
点评 本题考查物质反应过程中定量关系的分析判断、常见氧化还原反应中、碳酸钠与盐酸的反应来分析溶液中离子的变化,明确离子反应的实质、离子性质、离子反应的定量关系和产物判断是解答的关键,题目难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案①混合气体平均摩尔质量不再变化
②v(A):v(B):v(C)=1:3:4
③A、B、C 的浓度不再变化
④C 的体积分数不再变化
⑤A、B、C 的分子数之比为 1:3:4
⑥混合气体的密度不再变化
⑦单位时间内消耗 amolA,同时生成 3amolB.
| A. | ③④⑦ | B. | ③④⑤⑥⑦ | C. | ②③④⑦ | D. | ①③⑤⑥⑦ |
 化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是( )
| A. | X元素可能是金属,也可能是非金属 | |
| B. | 反应①、②、③均为氧化还原反应 | |
| C. | 反应②、③为可逆反应 | |
| D. | 若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂 |
| A. | NH4NO3 | B. | NaOH | C. | MgSO4 | D. | Na2SO4 |
| A. | c(K+)+c(H+)═c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(K+)>c(HS-)>c(H+)>c(OH-) |
Ⅰ、与水一样,甲醇也能微弱电离:2CH5OH(l)?CH3OH2++CH3O-,它也存在一个类似Kw的离子积Km,且25℃时MKm=2.0×10-17.往一定量的甲醇中加入金属钠,则有关叙述不正确的是A
A.金属钠与甲醇反应比金属钠与水反应更强烈
B.结合H+的能力CH3O->OH-
C.温度不变,所得溶液中c(CH3O-)和c(CH3OH2+)的乘积为常数
D.所得溶液中c(Na+)+c(CH3OH2+)═c(CH3O-)
Ⅱ、已知在常温下常压下:
①2CH3OH+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②CO(g)+O2(g)═2CO2(g)△H=-566.0KJ/mol
③H2O(g)═H2O(l)△H=-44.0KJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为442.8KJ.
Ⅲ、某同学设计了一个酸性甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1.
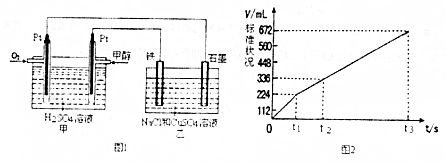
(1)写出甲中通入甲醇一极的电极反应式CH3OH-6e-+H2O=CO2↑+6H+.
(2)图2表示乙中阳极(选填“阴”或“阳”)产生气体的体积与电解时间的关系.当该极产生336mL气体时,理论上甲中消耗O2 224mL(标况).
Ⅳ、工业上常用两种方法生产甲醇:
方法一:CO(g)+2H2(g)?CH3OH(g)△H<0
(1)能说明该反应已达平衡状态的是B(填写序号字母).
A.n(CO):n(H2):n(CH3OH)=1:2:1
B.恒温恒容,气体总压强保持不变
C.H2的消耗速率与CH3OH的生成速率之比为2:1
D.恒温恒容,混合气体的密度保持不变
(2)下列措施能使容器中$\frac{n(C{H}_{3}OH)}{c(CO)}$增大的是C.
A.升高温度
B.将CH3OH从容器中分离出去一部分
C.体积不变,充入氢气
D.选用更有效的催化剂
E.体积不变,充入氦气,使体系压强增大
方法二:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0KJ/mol
某温度下,在容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,达到平衡时的能量变化数据如表:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
(2)a=19.6;B容器中反应达到平衡时,CH3OH的转化率是40%.
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,再次平衡时CH3OH的物质的量大于1.2mol.(选填“大于”、“小于”或“等于”)
 )和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠(
)和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠( )与NaOH、生石灰共热生成苯的化学方程式:
)与NaOH、生石灰共热生成苯的化学方程式: +NaOH
+NaOH  +Na2CO3.
+Na2CO3. 来制取
来制取 需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.
需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.
 .
. )脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”). .
.