题目内容
13.当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )| A. | NH4NO3 | B. | NaOH | C. | MgSO4 | D. | Na2SO4 |
分析 为使Mg(OH)2固体的量减少,可使溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)正向移动,则加酸或水解显酸性的物质,以此来解答.
解答 解:A.加NH4NO3,c(OH-)减小,溶解平衡正向移动,Mg(OH)2固体的量减少,故A选;
B.加NaOH,c(OH-)增大,溶解平衡逆向移动,Mg(OH)2固体的量增大,故B不选;
C.加MgSO4,c(Mg2+)增大,溶解平衡逆向移动,Mg(OH)2固体的量增大,故C不选;
D.加Na2SO4,对溶解平衡无影响,Mg(OH)2固体的量不变,故D不选;
故选A.
点评 本题考查溶解平衡移动,为高频考点,把握离子浓度对溶解平衡的影响为解答关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
3.有关能量的判断或表示方法正确的是( )
| A. | 已知中和热为57.3kJ/mol,则含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量为57.3 kJ | |
| B. | 从C(石墨)=C(金刚石)△H=+119kJ/mol;可知:石墨比金刚石更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| D. | 2g H2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2 H2O(l)△H=-285.8kJ/mol |
1.100℃时,某强酸溶液pH=4,强碱溶液pH=9,酸碱溶液混合pH=6,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
| A. | V(酸)=10V(碱) | B. | V(碱)=10V(酸) | C. | V(酸)=9V(碱) | D. | V(碱)=9V(酸) |
8.获得“863”计划和中科院一百人计划支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
5.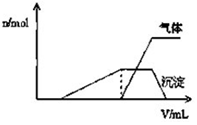 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
2.已知常温时CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是( )
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+)/c(NH3•H2O)先增大再减小 | |
| C. | 当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
3.下列叙述正确的是( )
| A. | 可用排水法收集二氧化氮气体 | |
| B. | 浓硝酸存放于棕色广口试剂瓶中 | |
| C. | 配制氯化亚铁溶液时,将氯化亚铁固体溶解在蒸馏水中加少量盐酸即可 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |