题目内容
9.下列说法正确的是( )| A. | 有的共价化合物在液态时也能导电 | |
| B. | 含有离子键的化合物中,也可能还含有共价键 | |
| C. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
分析 A.共价化合物在液态时不发生电离;
B.含有离子键的化合物是离子化合物;
C.铵根离子与酸根离子形成离子键;
D.铵盐是非金属元素形成的离子键.
解答 解:A.共价化合物在液态时不发生电离,不存在离子,所以不导电,故A错误;
B.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如NaOH属于离子化合物含有共价键,故B正确;
C.铵根离子与酸根离子形成离子键,铵根离子不是金属阳离子,故C错误;
D.铵盐是非金属元素形成的离子键,所以非金属元素形成的化合物可能存在离子键,如氯化铵,故D错误.
故选B.
点评 本题考查离子键、共价键、离子化合物、共价化合物,熟悉概念及概念的要点来判断,并学会利用举例的方法来说明选项的正误,难度不大.

练习册系列答案
相关题目
19.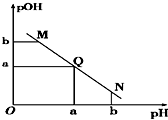 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )| A. | M点所示溶液导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度不相同 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
20.垃圾无害化处理有利于保护生态环境.下列有关生活垃圾的处理合理的是( )
| A. | 废旧塑料露天焚烧 | B. | 用厨房垃圾生产沼气 | ||
| C. | 废旧电池就地填埋 |
4.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体.并作相应的实验:
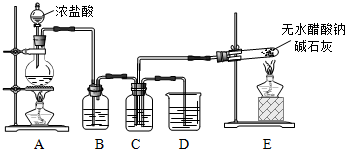
(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①B装置的作用是除去Cl2中含有的HCl;
②C装置所盛放试剂是饱和食盐水;光照后所得产物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl;
(3)设计一个实验方案,验证产物中生成了一种无机物:光照后,取C和D中液体各少许,分别加入两支试管中,再分别滴加2滴石蕊溶液,C中溶液红色更深;或用pH试纸测定C和D中溶液的pH等
(4)某学生为了测定X的组成进行实验探究,选用了下列仪器:
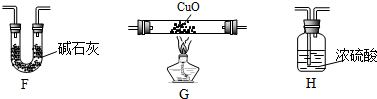
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
数据是否完全,说明原因数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C装置实验前后的质量;
该测定含氢量是否有偏差?若有偏差,请说明原因F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H中吸收的是水蒸气,H2O质量51.4g-42.4g=9.0g,n(H)=$\frac{9.0g}{18g/mol}$×2=1.0mol;
故n(C):n(H)>1:4.原因是F装置后面与空气接触,空气中的水蒸气和CO2进入了B装置,造成含碳量偏大.

(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①B装置的作用是除去Cl2中含有的HCl;
②C装置所盛放试剂是饱和食盐水;光照后所得产物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl;
(3)设计一个实验方案,验证产物中生成了一种无机物:光照后,取C和D中液体各少许,分别加入两支试管中,再分别滴加2滴石蕊溶液,C中溶液红色更深;或用pH试纸测定C和D中溶液的pH等
(4)某学生为了测定X的组成进行实验探究,选用了下列仪器:

①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
该测定含氢量是否有偏差?若有偏差,请说明原因F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H中吸收的是水蒸气,H2O质量51.4g-42.4g=9.0g,n(H)=$\frac{9.0g}{18g/mol}$×2=1.0mol;
故n(C):n(H)>1:4.原因是F装置后面与空气接触,空气中的水蒸气和CO2进入了B装置,造成含碳量偏大.
1.某元素原子的结构示意图为 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )
 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )| A. | 核电荷数为32 | B. | 核外电子数为6 | ||
| C. | 有3个电子层 | D. | 比其阴离子多2个电子 |
18.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |
19.4-甲基-2-乙基-1-戊烯,经加氢后产物的名称是( )
| A. | 2,4-二甲基己烷 | B. | 2,5-二甲基己烷 | ||
| C. | 4-甲基-2-乙基戊烷 | D. | 2-乙基-4-甲基戊烷 |
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学. ,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.
,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.