题目内容
14.3-氯-2-丁氨酸的结构简式为: ,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.
,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.
分析 连接4个不同原子或原子团的碳原子为手性碳原子,据此特点判断该有机物分子中含有手性碳原子个数;根据价层电子对互斥理论确定N原子杂化类型.
解答 解:连接4个不同原子或原子团的碳原子为手性碳原子,3-氯-2-丁氨酸的结构简式为 ,“*”为手性碳原子,所以一个该有机物分子中含有2个手性碳原子,其中-NH2中氮原子含有一个孤电子对和三个共价键,则N原子的价层电子对数为4,所以杂化类型为sp3杂化,
,“*”为手性碳原子,所以一个该有机物分子中含有2个手性碳原子,其中-NH2中氮原子含有一个孤电子对和三个共价键,则N原子的价层电子对数为4,所以杂化类型为sp3杂化,
故答案为:2;sp3.
点评 本题考查手性碳原子的判断和杂化轨道类型,掌握手性碳原子的特点以及杂化理论的应用是解答关键,手性碳原子判断注意:手性碳原子一定是饱和碳原子,题目难度不大.

练习册系列答案
相关题目
4.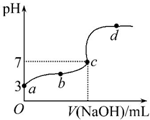 已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
 已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A. | a点表示的溶液中c(HCOO-)约为10-3mol•L-1 | |
| B. | 用25 mL的酸式滴定管量取HCOOH溶液 | |
| C. | c点NaOH溶液的体积小于10 mL | |
| D. | 在a、c间任一点,溶液中一定都有c(HCOO-)>c(Na+)>c(H+)>c(OH-) |
5.一定条件下,氨气和氟气发生反应:4NH3+3F2→NF3+3NH4F,其中产物NF3分子结构和NH3相似.下列有关说法错误的是( )
| A. | NF3分子呈三角锥形 | |
| B. | NF3分子是极性分子 | |
| C. | NF3与NH3晶体类型相同 | |
| D. | 上述反应的反应物和生成物均属于共价分子 |
2.东汉《周易参同契》中记载:“胡粉投火中,色坏还为铅”,实验表明胡粉难溶于水,加强热产生能使澄清的石灰水浑浊的湿气.胡粉的主要成分( )
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
9.下列说法正确的是( )
| A. | 有的共价化合物在液态时也能导电 | |
| B. | 含有离子键的化合物中,也可能还含有共价键 | |
| C. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
19.下列说法中正确的是( )
| A. | 两个原子或多个原子之间的相互作用叫做化学键 | |
| B. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属原子和非金属原子化合时才能形成离子键 | |
| D. | 大多数的盐、碱和金属氧化物中含有离子键 |
6.在氨水中存在NH3•H2O?NH4++OH-的平衡,若要使平衡向逆方向移动,同时使c(OH-)增大,应加入( )
| A. | 氯化铵固体 | B. | 硫酸 | C. | NaOH固体 | D. | 大量水 |
4.下列离子方程式不正确的是( )
| A. | 碳酸铵溶液中通入足量二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | 氯化铵溶液中加入稀氢氧化钠溶液:NH4++OH-?NH3•H2O | |
| C. | 氯化铵固体和熟石灰共热:NH4++OH-═NH3↑+H2O | |
| D. | 硫酸铵溶液与氢氧化钡溶液共热:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ BaSO4↓+2NH3↑+2H2O |