题目内容
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、常温常压下,8gO2和O3的混合物含有2AA个电子 |
| B、29gC4H10中含有的共价键个数为13NA |
| C、1L1 moI?L-1的NaClO溶液中含有ClO的数日为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.质量转换成物质的量,结合氧气和臭氧的组成解答;
B.1mol丁烷分子中含有3mol碳碳键和10mol碳氢键;
C.次氯酸根离子在水中部分水解;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
B.1mol丁烷分子中含有3mol碳碳键和10mol碳氢键;
C.次氯酸根离子在水中部分水解;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
解答:
解:A.8gO2和O3所含的氧原子的质量为8g,含有0.5mol氧原子,含有的电子数为0.5mol×8×NA=4NA,故A错误;
B.29gC4H10物质的量=
=0.5mol,含有的共价键个数=0.5mol×13×NA=6.5NA,故B错误;
C.ClO-是弱离子在水溶液中要发生水解,故1L 1mol?L-1 NaClO溶液中含有ClO-的数目小于NA,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选:D.
B.29gC4H10物质的量=
| 29g |
| 58g/mol |
C.ClO-是弱离子在水溶液中要发生水解,故1L 1mol?L-1 NaClO溶液中含有ClO-的数目小于NA,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选:D.
点评:本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意弱酸根离子的水解,选项C为易错选项.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列离子方程式正确的是( )
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
将钠、镁、铝各0.3mol,分别放入100mL 1mol?L-1的硫酸中,同温同压下产生的气体的体积比是( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:2 |
| D、3:1:1 |
可逆反应N2(g)+3H2(g )?2NH3(g),在500℃时,将2mol N2和2mol H2充入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
| A、0.08mol?L-1 |
| B、0.12 mol?L-1 |
| C、0.05 mol?L-1 |
| D、0.14mol?L-1 |
1L浓度为1mol/L的FeCl3溶液与3L 1mol/L的KCl溶液中Cl-物质的量浓度之比为( )
| A、3:2 | B、1:1 |
| C、3:1 | D、1:3 |
下列离子方程式中,表达正确的是( )
| A、等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-=BaCO3↓+H2O | ||||
| B、向AlCl3溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
C、用铜作电极电解硫酸溶液:2H2O
| ||||
| D、硫酸亚铁溶液和稀硫酸、过氧化氢混合:Fe2++2H2O2+4H+=Fe3++4H2O |
A、B、C、D四种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍.下列说法正确的是( )
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
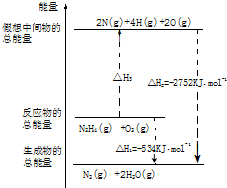 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.