题目内容
19.如图是工业“从海水中提取镁”的简易流程示意图.下列说法中不正确的是( )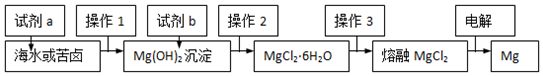
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
分析 从海水中提取镁的工艺流程:利用贝壳分解生成氧化钙,溶于水得到试剂a为氢氧化钙加入到海水或苦卤中沉淀镁离子,操作1是过滤得到氢氧化镁沉淀,加入试剂b盐酸溶解,通过操作2为浓缩蒸发、冷却结晶方法得到氯化镁晶体,操作3是在氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁.
解答 解:试剂a为氢氧化钙加入到海水或苦卤中沉淀镁离子,操作1是过滤得到氢氧化镁沉淀,加入试剂b盐酸溶解,通过操作2为浓缩蒸发、冷却结晶方法得到氯化镁晶体,操作3是在氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁,
A.试剂a应为氢氧化钙,氢氧化钠碱性强价格高,试剂b为盐酸溶解氢氧化镁沉淀,故A错误;
B.操作2是从溶液中得到溶质晶体的操作,方法是加热浓缩蒸发、冷却结晶得到氯化镁晶体,故B正确;
C.操作3为氯化氢气流中加热氯化镁晶体失去结晶水,故C正确;
D.电解熔融氯化镁,阳极是氯离子失电子生成氯气,镁离子在阴极上得到电子生成镁,故D正确;
故选A.
点评 本题考查元素及其化合物,明确流程中发生的化学反应是解答的关键,注重基础知识和实验基本技能的训练,题目难度中等.

练习册系列答案
相关题目
9.下列操作正确的是( )
| A. | pH试纸直接蘸取NaOH溶液测定其pH | |
| B. | 存放化学品的仓库失火后,尽快用水灭火 | |
| C. | 蒸馏时,加热一段时间后,再投入沸石 | |
| D. | 切割剩下的白磷放回原试剂瓶水封保存 |
10.下列关于浓硫酸的叙述正确的是( )
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 | |
| D. | 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
7.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2和10g O2 | B. | 11.2L(标准状况)H2O和0.5mol Br2 | ||
| C. | 5.6L N2(标准状况)和11g CO2 | D. | 224mL H2(标准状况)和0.1mol N2 |
4.向含有下列4种离子的溶液中加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
| A. | NO3- | B. | Ba2+ | C. | OH- | D. | Cu2+ |
11.短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,Y原子的核外电子数是R的2倍,下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | 可用YO2+Z2+2H2O=H2YO4+2HZ,证明非金属性:Z>Y | |
| B. | 含有Z元素的钠盐溶液都呈中性 | |
| C. | 由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y | |
| D. | 最简单气态氢化物的热稳定性:R>X |
8.铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极).下列说法正确的是( )
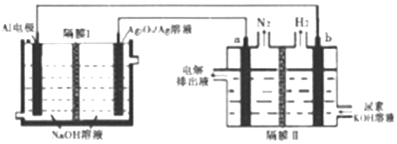

| A. | Ag电极是正极,反应后该电极区溶液pH减小 | |
| B. | 原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O | |
| C. | a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O | |
| D. | 每消耗2.7g铝,理论上a、b两级共产生气体3.36L(标准状况) |
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: