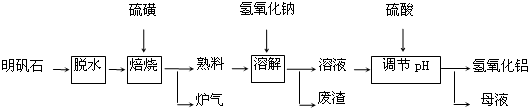
题目内容
11.短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,Y原子的核外电子数是R的2倍,下列说法正确的是( )| R | ||
| X | Y | Z |
| A. | 可用YO2+Z2+2H2O=H2YO4+2HZ,证明非金属性:Z>Y | |
| B. | 含有Z元素的钠盐溶液都呈中性 | |
| C. | 由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y | |
| D. | 最简单气态氢化物的热稳定性:R>X |
分析 由短周期元素R、X、Y、Z在元素周期表中的相对位置,Y原子的核外电子数是R的2倍,可知R为O,Y为S,结合位置可知X为P,Z为Cl,
A.YO2+Z2+2H2O=H2YO4+2HZ中,Cl得到电子,S失去电子;
B.NaCl为中性,NaClO溶液水解显碱性,硫酸氢钠电离显酸性;
C.非金属性越强,对应最高价氧化物对应的水化物的酸性越强;
D.非金属性越强,对应氢化物的稳定性越强.
解答 解:由短周期元素R、X、Y、Z在元素周期表中的相对位置,Y原子的核外电子数是R的2倍,可知R为O,Y为S,结合位置可知X为P,Z为Cl,
A.YO2+Z2+2H2O=H2YO4+2HZ中,Cl得到电子,S失去电子,但不能比较非金属性,可利用非金属元素单质的置换反应比较非金属性Cl>S,故A错误;
B.NaCl为中性,NaClO溶液水解显碱性,硫酸氢钠电离显酸性,则含有Z元素的钠盐溶液不一定为中性,故B错误;
C.非金属性越强,对应最高价氧化物对应的水化物的酸性为Z>Y,但氧化性无此规律,故C错误;
D.非金属性R>X,对应氢化物的稳定性为R>X,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握R、Y推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,选项A为易错点,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
2.有一种无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种.为确定其成分,进行如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入过量的Na2O2固体后白色沉淀部分溶解,②另取部分溶液,加入HCl酸化的BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl- | B. | 肯定有Al3+、Mg2+、NH4+、Cl- | ||
| C. | 肯定有HCO3-、K+、MnO4- | D. | 肯定有Al3+、Mg2+、SO42- |
19.如图是工业“从海水中提取镁”的简易流程示意图.下列说法中不正确的是( )
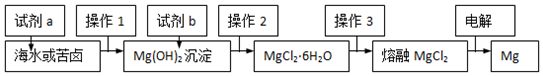

| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
6.下列有关物质用途的说法中,不正确的是( )
| A. | 氯气可做自来水消毒剂 | B. | 碳酸钠可用于制造玻璃制造肥皂 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Na2O2用作潜水艇供氧剂 |
16.氨在生活、生产、科研中有广泛用途,而氮的氧化物则是造成大气污染的主要物质.
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g)、Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
①30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是分离出二氧化碳.
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数等于(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为54.5%(保留三位有效数字)
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g)、Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数等于(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为54.5%(保留三位有效数字)
3.下列说法不正确的是( )
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 灼烧某物质时,用肉眼直接观察到火焰呈黄色,则可判断该物质一定含钠元素 | |
| C. | 将镁条放在空气中充分燃烧,可以得到三种固体 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液,则放出氢气的体积相等(同温同压下) |
5.将2molPCl3和1molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g),达平衡时PCl5为0.4mol,如果此时移走1.0molPCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A. | 0.4mol | B. | 小于0.2mol | ||
| C. | 大于0.2mol | D. | 大于0.2mol,小于0.4mol |