题目内容
10.下列关于浓硫酸的叙述正确的是( )| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 | |
| D. | 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
分析 A.浓硫酸具有脱水性,能将蔗糖中的H、O以2:1水的形式脱去;
B.浓硫酸在常温下和铜不反应;
C.硫化氢气体具有还原性,氨气是碱性气体,而浓硫酸是具有强氧化性的酸性干燥剂;
D.常温下,浓硫酸和铁、铝能发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象.
解答 解:A.浓硫酸具有脱水性,能将蔗糖中的H、O以2:1水的形式脱去而体现脱水性,故A正确;
B.浓硫酸在常温下和铜不反应,在加热条件下和铜反应生成二氧化硫,故B错误;
C.硫化氢气体具有还原性,氨气是碱性气体,而浓硫酸是具有强氧化性的酸性干燥剂,因浓硫酸与硫化氢发生氧化还原反应,与氨气发生化合反应生成硫酸铵,所以两者不能用浓硫酸干燥,故C错误;
D.常温下,浓硫酸和铁、铝能发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,而不是不反应,故D错误;
故选A.
点评 本题考查了浓硫酸的性质,明确浓硫酸的三大性质是解本题关键,注意吸水性和脱水性的区别,题目难度不大.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18 g•mol-1 | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 1 mol NaCl溶于1 L水中,形成1 mol•L-1NaCl溶液 |
15.实验室有一瓶溶液,标签上标有“BaCl2 0.2mol•L-1”的字样,下面是某同学对该溶液的叙述,正确的是( )
| A. | 配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中 | |
| B. | Ba2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol•L-1 | |
| D. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol•L-1 |
2.有一种无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种.为确定其成分,进行如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入过量的Na2O2固体后白色沉淀部分溶解,②另取部分溶液,加入HCl酸化的BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl- | B. | 肯定有Al3+、Mg2+、NH4+、Cl- | ||
| C. | 肯定有HCO3-、K+、MnO4- | D. | 肯定有Al3+、Mg2+、SO42- |
19.如图是工业“从海水中提取镁”的简易流程示意图.下列说法中不正确的是( )
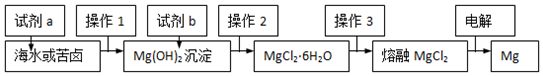

| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |