题目内容
7.下列各组物质中,所含分子数相同的是( )| A. | 10g H2和10g O2 | B. | 11.2L(标准状况)H2O和0.5mol Br2 | ||
| C. | 5.6L N2(标准状况)和11g CO2 | D. | 224mL H2(标准状况)和0.1mol N2 |
分析 由N=nNA可知,物质的量相同时分子数相同,结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$计算.
解答 解:A.氢气的摩尔质量为2g/mol、氧气的摩尔质量为32g/mol,等质量时物质的量不同,分子数不同,故A不选;
B.标准状况时H2O为液体,11.2L时其体积为$\frac{11200g}{18g/mol}$>0.5mol,分子数不同,故B不选;
C.n(N2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,n(CO2)=$\frac{11g}{44g/mol}$=0.25mol,则分子数相同,故C选;
D.n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,与0.1mol N2的分子数不同,故D不选;
故选C.
点评 本题考查物质的量的计算,为高频考点,把握物质的量与质量、体积、微粒数的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
10.下列各澄清溶液中离了能大量共存,且加入(或滴入)X试剂后发反应的离子方程式书写正确的是( )
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Na+、K+、ClOˉ、SO42ˉ | 少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| B | NH4+、Fe3+、Brˉ、SO42ˉ | 过量H2S | 2Fe3++H2S=2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | Cu+2Fe3+═2Fe2++Cu2+ |
| D | Na+、K+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H20═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
18.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18 g•mol-1 | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 1 mol NaCl溶于1 L水中,形成1 mol•L-1NaCl溶液 |
15.实验室有一瓶溶液,标签上标有“BaCl2 0.2mol•L-1”的字样,下面是某同学对该溶液的叙述,正确的是( )
| A. | 配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中 | |
| B. | Ba2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol•L-1 | |
| D. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol•L-1 |
2.有一种无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种.为确定其成分,进行如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入过量的Na2O2固体后白色沉淀部分溶解,②另取部分溶液,加入HCl酸化的BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl- | B. | 肯定有Al3+、Mg2+、NH4+、Cl- | ||
| C. | 肯定有HCO3-、K+、MnO4- | D. | 肯定有Al3+、Mg2+、SO42- |
19.如图是工业“从海水中提取镁”的简易流程示意图.下列说法中不正确的是( )
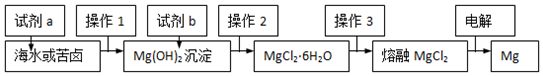

| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
16.氨在生活、生产、科研中有广泛用途,而氮的氧化物则是造成大气污染的主要物质.
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g)、Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
①30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是分离出二氧化碳.
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数等于(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为54.5%(保留三位有效数字)
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g)、Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数等于(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为54.5%(保留三位有效数字)
1.在一密闭容器中CO、H2、O2混合气体共20g和足量的Na2O2用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是( )
| A. | 0.6 | B. | 0.333 | C. | 0.4 | D. | 0.36 |