题目内容
14.酸、碱、盐在水溶液中发生的复分解反应,实质上是离子反应,这类反应发生的条件是生成难溶物(沉淀)、产生易挥发性物质(气体)或生成难电离物质(水).只要具备上述条件之一,反应就能发生.分析 电解质在溶液中电离产生离子,依据复分解反应发生的条件,离子之间能够发生反应生成沉淀、气体或者弱电解质,离子间发生反应而不共存.
解答 解:电解质在溶液中电离产生离子,电解质溶液之间的反应,这类离子反应发生的条件,实质上是复分解反应发生的条件,复分解反应发生的条件为:
生成难溶物(沉淀),产生易挥发性物质(气体),生成难电离物质(水),
故答案为:生成难溶物(沉淀)、产生易挥发性物质(气体)、生成难电离物质(水).
点评 本题考查了电解质溶液之间的反应实质,明确电解质性质及在溶液中存在形式,熟悉复分解反应发生的条件是解题关键,题目难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
12.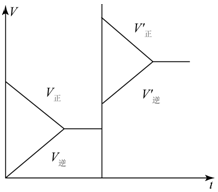 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
5.向22.4gFe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,则固体剩余的质量为( )
| A. | 6.4g | B. | 4.8g | C. | 17.6g | D. | 20.2g |
2.下列依据相关实验得出的结论,正确的是( )
| A. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中无K+ | |
| B. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| C. | 向某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
9.下列实验中,对应的现象以及结论都正确且两者具有因果关系是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铜粉中 | 溶液变蓝,试管口观察到了红棕色气体 | 铜将稀硝酸还原成二氧化氮 |
| B | 将SO2通入过量的饱和NaHCO3溶液中 | 有无色无味气体产生 | 非金属性:S大于C |
| C | 乙醇和浓硫酸混合加热,将产生的气体通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 证明乙醇发生了消去反应产生烯烃 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1 CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
6.常温常压下,改变下列条件,能使饱和硫化氢溶液中$\frac{c({H}^{+})}{c({S}^{2-})}$增大的是( )
| A. | 通入少量NH3 | B. | 加入少量硫化钠 | C. | 通入少量Cl2 | D. | 通入少量H2S |
3.化学与生活密切相关,下列说法不正确的是( )
| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
4.下列说法正确的是( )
| A. | 硬脂酸甘油酯和乙酸乙酯都属于酯类物质,都能发生皂化反应 | |
| B. | 制造纸张的原料棉花、制造毛皮大衣的原料皮革,它们的主要成分都是纤维素 | |
| C. | 在淀粉水解液中加过量NaOH,滴加碘水,如溶液未显蓝色,则证明淀粉水解完全 | |
| D. | 体积分数75%的乙醇溶液可用于医疗消毒,原理是乙醇使细菌的蛋白质发生变性 |