题目内容
3.化学与生活密切相关,下列说法不正确的是( )| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
分析 A.次氯酸钠在溶液中会生成HClO,HClO具有强氧化性;
B.硅胶具有吸水性;
C.硫燃烧生成SO2;
D.依据盐类水解的性质解答.
解答 解:A.次氯酸钠在溶液中会生成HClO,HClO具有强氧化性,能杀菌消毒,所以次氯酸钠溶液可用作环境的杀菌消毒,故A正确;
B.硅胶具有吸水性,硅胶可用作商品包装袋的干燥剂,故B正确;
C.硫燃烧生成SO2,则爆竹燃放后,硫燃烧生成SO2,不生成SO3,故C错误
D.草木灰中的碳酸根离子水解显碱性,铵态氮肥中铵根离子水解显酸性,二者相互促进,导致肥效降低,所以不能混合使用,故D正确.
故选C.
点评 本题考查物质用途,侧重考查元素化合物知识,明确物质性质即可解答,性质决定用途,用途体现性质,题目难度不大.

练习册系列答案
相关题目
13.稀土元素是周期表中ⅢB族钪、钇和镧系元素之总称,金属活泼性仅次于碱金属和碱土金属元素,它们的性质极为相似,常见化合价为+3价.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇.
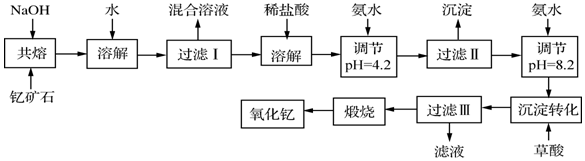
已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表.
②Be(OH)2+2NaOH═Na2BeO2+2H2O
请回答下列问题:
(1)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为Y2O3•FeO•2BeO•2SiO2
(2)过滤Ⅲ所得滤液的溶质主要有NH4Cl、(NH4)2C2O4(填化学式)
(3)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用bd两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
②写出Na2BeO2与足量盐酸发生反应的离子方程式BeO22-+4H+=Be2++2H2O.
(4)能否用氨水直接将溶液的pH调节至8.2,不能(填能或不能),(若不能,请说明理由)第一步用氨水是为了使Fe3+转化为沉淀而除去.
(5)写出沉淀转化步骤中沉淀转化的化学方程式2Y(OH)3+3H2C2O4═Y2(C2O4)3+6H2O.

已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
请回答下列问题:
(1)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为Y2O3•FeO•2BeO•2SiO2
(2)过滤Ⅲ所得滤液的溶质主要有NH4Cl、(NH4)2C2O4(填化学式)
(3)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用bd两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
②写出Na2BeO2与足量盐酸发生反应的离子方程式BeO22-+4H+=Be2++2H2O.
(4)能否用氨水直接将溶液的pH调节至8.2,不能(填能或不能),(若不能,请说明理由)第一步用氨水是为了使Fe3+转化为沉淀而除去.
(5)写出沉淀转化步骤中沉淀转化的化学方程式2Y(OH)3+3H2C2O4═Y2(C2O4)3+6H2O.
11.短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y的次外层电子数是最外层的$\frac{1}{3}$,ZX是一种生氢剂,W与Y同一主族,下列叙述正确的是( )
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物ZX中各原子均满足8电子稳定结构 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 简单气态氢化物稳定性:W>Y |
18.一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表
下列说法正确的是( )
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 随pH的升高,碳钢腐蚀速率逐渐加快 | |
| B. | pH<4,发生析氢腐蚀 | |
| C. | pH为14,其负极反应为2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH为7时,负极反应为Fe_3e-═Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 |
8.用NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数为4NA | |
| C. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA | |
| D. | 常温下,2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同 |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al(OH )3能溶于氨水 |
| B | 将浓硫酸滴在胆矾晶体上 | 蓝色晶体变白 | 浓硫酸具有脱水性 |
| C | 将新制的氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 | Cl2有漂白性 |
| D | 向某晶体的水溶液中加入2滴FeSO4溶液 | 产生特征蓝色沉淀 | 该晶体中一定含有[F e(CN)6]3- |
| A. | A | B. | B | C. | C | D. | D |
12.下列变化过程需要加入氧化剂才能实现的是( )
| A. | HCl→H2 | B. | FeCl3→FeCl2 | C. | SO2→H2SO4 | D. | CO32-→HCO3- |
2.由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.
已知反应N2(g)+3H2(g)2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为391kJ/mol.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |