题目内容
19.某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的
是防止Fe2+被氧化.在配制100mL该溶液的过程中需要用到的仪器除烧杯,量筒,玻璃棒,托盘天平,药匙,还必须
用到的主要仪器100mL容量瓶、胶头滴管.若洗涤时未将洗液转入,则所得溶液浓度小于0.1mol/L(填“大
于”、“等于”或“小于”).,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”、“等于”或“小于”).
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-.
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是隔离空气(排除氧气对实验的影响).
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合,生成I20.0003mol.
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液•变成棕黄色,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;一段时间后.溶液中有气泡出现,并放出热量.随后有红褐色沉淀生成.产生气泡的原因是Fe3+催化氧化H2O2分解产生O2.
分析 (1)氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;由固体配置溶液需要的仪器有容量瓶、胶头滴管、烧杯、量筒、玻璃棒、托盘天平、药匙;洗涤时未转移洗涤液至容量瓶,溶质损失,所得溶液浓度偏小,若定容时仰视刻度线,加入的蒸馏水偏多,则所得溶液浓度偏小;
(2)亚铁离子与氯气反应生成铁离子和氯离子;
(3)空气氧化亚铁离子,煤油的作用是隔绝空气,避免对实验的干扰;
(4)根据反应2Fe3++2I-?2Fe2++I2,氯化铁充分反应,根据方程计算碘的物质的量;
(5)酸性条件下H2O2将亚铁离子氧化为铁离子,铁离子能催化H2O2分解产生氧气.
解答 解:(1)在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化,配制100mL溶液需要的仪器有100mL,容量瓶、胶头滴管、烧杯、量筒、玻璃棒、托盘天平、药匙,洗涤时未转移洗涤液至容量瓶,溶质损失,所得溶液浓度偏小,若定容时仰视刻度线,加入的蒸馏水偏多,则所得溶液浓度偏小;
故答案为:防止Fe2+被氧化;100mL容量瓶、胶头滴管;小于;小于;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响;
故答案为:隔离空气(排除氧气对实验的影响);
(4)10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合,发生反应2Fe3++2I-?2Fe2++I2,氯化铁反应充分,则生成I2由氯化铁计算,为$\frac{1}{2}$×0.1mol/L×6×10-3L=0.0003mol;
故答案为:0.0003mol;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,发生的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3+催化氧化H2O2分解产生O2,故一段时间后,溶液中有气泡出现;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O; Fe3+催化氧化H2O2分解产生O2.
点评 本题考查了铁元素的两种离子的性质,涉及氧化还原反应、离子方程式书写、离子检验等知识点,注意题干信息的分析判断,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

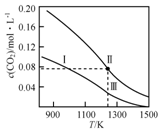 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
| A. | 强酸pH=a,加水稀释到10n倍,则pH=a+n | |
| B. | 弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7) | |
| C. | 强碱pH=b,加水稀释到10n倍,则pH=b-n | |
| D. | 弱碱pH=b,加水稀释到10n倍,则pH=b-n(b-n>7) |
| A. | CH2═CHCH(CH3)2的名称是3-甲基-1-丁烯 | |
| B. | 由乙醇生成乙醛属于还原反应 | |
| C. | 乙烯与苯乙烯为同系物 | |
| D. | 乙苯分子中所有碳原子一定共平面 |
| A. | lmolKClO3参加反应生成气体的体积为22.4L(标况下) | |
| B. | 该反应的还原产物为CO2 | |
| C. | 0.5mol H2C2O4参加反应有lmol电子转移 | |
| D. | H2SO4在反应中是氧化剂 |
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物ZX中各原子均满足8电子稳定结构 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 简单气态氢化物稳定性:W>Y |
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数为4NA | |
| C. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA | |
| D. | 常温下,2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同 |
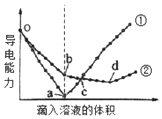 在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | o-b段,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | bd段,发生的离子方程式:OH-+H+═H2O | |
| C. | c点,两溶液中阴、阳离子的浓度之和相等 | |
| D. | o-a段加入溶液的体积为20mL,则NaHSO4溶液的浓度为0.75mol/L |