题目内容
1.(1)以锌、铜为两极,稀硫酸为电解质溶液组成的原电池的正极反应式是:2H++2e-=H2↑负极反应式是:Zn-2e-=Zn2+?
(2)写出下列反应的化学方程式,并指出氧化剂和还原剂
①钠在氧气中燃烧:化学方程式:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,氧化剂:O2,还原剂:Na.
②钾与水反应:化学方程式:2K+2H2O=2KOH+H2↑,氧化剂:H2O,还原剂:K.
分析 (1)活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的阳离子得电子;
(2)①金属钠在氧气中燃烧生成过氧化钠,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
②钾和水反应生成氢氧化钾和氢气,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂.
解答 解:(1)以锌、铜为两极,稀硫酸为电解质溶液组成的原电池,活泼性强的金属Zn作负极,发生氧化反应:Zn-2e-=Zn2+,活泼性弱的Cu作正极,发生还原反应:2H++2e-=H2↑,故答案为:2H++2e-=H2↑ Zn-2e-=Zn2+;
(2)①金属钠在氧气中燃烧生成过氧化钠,2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,化合价升高元素所在的反应物Na是还原剂,化合价降低元素所在的反应物O2是氧化剂;
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;O2;Na;
②钾和水反应生成氢氧化钾和氢气,化学方程式为:2K+2H2O=2KOH+H2↑,化合价升高元素所在的反应物K是还原剂,化合价降低元素所在的反应物H2O是氧化剂,故答案为:2K+2H2O=2KOH+H2↑;H2O;K.
点评 本题考查原电池的工作原理以及氧化还原反应中的基本概念,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
12.下列说法正确的是( )
| A. | 钾(K)原子基态的原子结构示意图为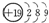 | |
| B. | Ca2+电子排布式为1s22s22p63s23p64s2 | |
| C. | 原子核内有10个中子的氧原子可表示为${\;}_{8}^{16}$O | |
| D. | H2O分子的电子式为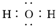 |
9.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | HClO | C. | PCl5 | D. | NH3 |
16.不属于“氮的固定”的变化是( )
| A. | 豆科植物的根瘤菌固氮 | B. | .由氮气和氢气合成氨气 | ||
| C. | .雷雨天,空气中的氮气和氧气反应 | D. | .氨催化氧化制硝酸 |
6.某烃的结构简式为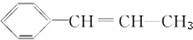 ,它可能具有的性质是( )
,它可能具有的性质是( )
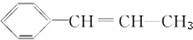 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水也易溶于有机溶剂 | |
| B. | 能发生加聚反应,其生成物可用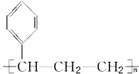 表示 表示 | |
| C. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
13.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
10.已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
11.2009年7月27日,俄科学家用钙-48原子轰击锫-249原子,预期得到117号超重元素,下列关于117号元素叙述正确的是( )
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |