题目内容
13.运用元素周期律分析下面的推断,其中不正确的是( )| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
分析 A.同主族元素的原子,从上到下氢化物的稳定性逐渐减弱;
B.根据同主族元素性质具有相似性和递变性判断,碘单质有颜色且AgI难溶于水和酸;
C.碱金属元素从上到下元素的金属性逐渐增强;
D.同主族元素的性质具有相似性,硫酸钡为难溶于水的白色固体.
解答 解:A.同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故A错误;
B.卤族元素性质具有相似性,根据碘单质的性质可推断At为有色物质,AgI不溶于水也不溶于稀酸,故AgAt难溶于水也不溶于稀硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.锶与钡是同主族元素,BaSO4是难溶于水的白色固体,所以SrSO4也是难溶于水的白色固体,故D正确.
故选A.
点评 本题考查同主族元素的性质的相似性和递变性,为高频考点,侧重于学生的分析能力的考查,有利于夯实双基,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
相关题目
3.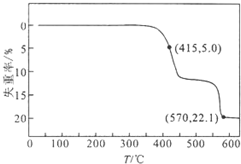 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、③的反应速率相等 |
8.下列叙述正确的是( )
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
18.三种卤化铅的溶解度曲线如图所示,下列说法正确的是( )


| A. | 三种卤化铅的溶解度均随温度的升高而减小 | |
| B. | 20℃时,PbCl2的Ksp约为1.87×10-4 | |
| C. | 任何温度下,始终存在:Ksp(PbCl2>Ksp(PbBr2>Ksp(PbI2) | |
| D. | 常温下,向浓度均为0.1mol•L-1的Cl-、Br-、I-混合溶液中,逐滴加入的Pb(NO3)2溶液,PbCl2最先沉淀 |
2.以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
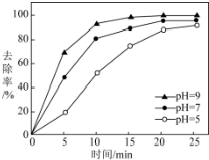
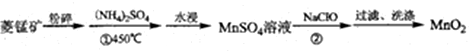
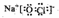 .
.