题目内容
18.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
分析 A.屠呦呦女士利用乙醚做萃取剂萃取除了青蒿素;
B.2.5微米大于100nm;
C.大理石不含硅元素;
D.光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水.
解答 解:A.屠呦呦女士利用乙醚做萃取剂萃取除了青蒿素,获得了诺贝尔化学奖,故A正确;
B.2.5微米大于100nm,直径小于2.5 μm,可能形成胶体,故B正确;
C.大理石不含硅元素,不属于硅酸盐,故C错误;
D.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故D正确.
故选C.
点评 本题考查化学史、材料、环境污染等知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
相关题目
14.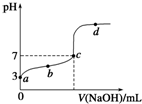 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
6.常温下,向20ml某浓度的硫酸溶液中滴入0.1mol.L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确是( )

| A. | V=40 | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
3.X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
10.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
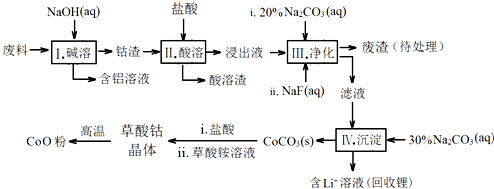
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$ Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$ Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
7.关于油和脂肪的下列说法不正确的是( )
| A. | 二者互为同分异构体 | B. | 二者是同系物 | ||
| C. | 前者为固体,后者液体 | D. | 在一定条件下前者可转化为后者 |
8.随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.

下列有关说法中正确的是( )

下列有关说法中正确的是( )
| A. | 元素f位于第三周期第Ⅲ族 | |
| B. | 离子的半径大小为r(d2一)>r(e+) | |
| C. | 元素g的最高价氧化物对应水化物的酸性比h的强 | |
| D. | 由x、z组成的一种四原子化合物的电子式为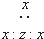 |

 ;
; .
.