题目内容
13.以乙烯为原料合成有机物G的路线如下:
回答下列问题:
(1)Y的结构简式为
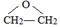 ;
;(2)X的化学名称是1,2-二溴乙烷;
(3)步骤Ⅲ的反应类型为酯化反应或取代反应;
(4)生成有机物G的化学反应方程式为
 .
.
分析 乙烯与溴发生加成反应生成X为BrCH2CH2Br,X发生水解反应得到乙二醇,乙烯与过氧化氢发生加成反应生乙二醇,乙烯氧化生成Y,Y与水反应生成乙二醇,则Y为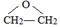 .乙二醇氧化生成乙二醛,乙二醛氧化生成乙二酸,乙二酸与乙二醇发生酯化反应生成环酯G为
.乙二醇氧化生成乙二醛,乙二醛氧化生成乙二酸,乙二酸与乙二醇发生酯化反应生成环酯G为 .
.
解答 解:乙烯与溴发生加成反应生成X为BrCH2CH2Br,X发生水解反应得到乙二醇,乙烯与过氧化氢发生加成反应生乙二醇,乙烯氧化生成Y,Y与水反应生成乙二醇,则Y为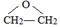 .乙二醇氧化生成乙二醛,乙二醛氧化生成乙二酸,乙二酸与乙二醇发生酯化反应生成环酯G为
.乙二醇氧化生成乙二醛,乙二醛氧化生成乙二酸,乙二酸与乙二醇发生酯化反应生成环酯G为 .
.
(1)Y的结构简式为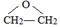 ,故答案为:
,故答案为: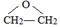 ;
;
(2)X为BrCH2CH2Br,化学名称是:1,2-二溴乙烷,故答案为:1,2-二溴乙烷;
(3)步骤Ⅲ的反应类型为酯化反应或取代反应,故答案为:酯化反应或取代反应;
(4)生成有机物G的化学反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,注意把握有机物的官能团的结构和性质,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.用NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCHCl3中含有碳氯键数目为0.3NA | |
| B. | 25℃时,0.1mol/L的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 1molNa2O和1molNa2O2的混合物中,含有的离子总数为7NA |
18.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
2.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 大米、面包是碱性食物 | D. | 鱼、牛奶是酸性食物 |
3. 氨是一种重要的化工产品.
氨是一种重要的化工产品.
(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
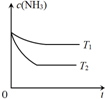
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则反应在该温度下平衡常数K=2.37(保留三三位有效数字);保持温度不变,30min时再向该密闭容器中投入0.5molN2、0.5molH2和1molNH3,此时反应将正向进行(填“正向进行”、“逆向进行”或“处于平衡状态”).
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 氨是一种重要的化工产品.
氨是一种重要的化工产品.(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
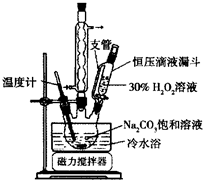 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.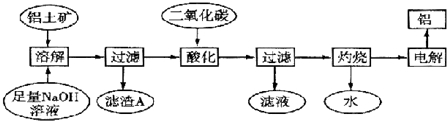
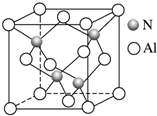 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.