题目内容
3.X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
分析 X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,最外层电子数为4,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;W原子的核外电子数是X原子与Z原子的核外电子数之和,则W的核外电子数是17,所以W是Cl元素,据此解答.
解答 解:X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,最外层电子数为4,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;W原子的核外电子数是X原子与Z原子的核外电子数之和,则W的核外电子数是17,所以W是Cl元素.
A.X、Y的氢化物分别为CH4、H2O,CH4的沸点在同族氢化物中最低,故A错误;
B.X、Y、Z分别是C、O、Na元素,含有三种元素的化合物有碳酸钠、醋酸钠、甲酸钠、醋酸钠等,故B正确;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大,一般电子层越多原子半径越大,故原子半径r(Na)>r(Cl)>r(C)>r(O),即原子半径r(Z)>r(W)>r(X)>r(Y),故C错误;
D.Y(O)与Z(Na)形成氧化钠、过氧化钠,过氧化钠含有共价键,Y(O)或W(Cl)形成的化合物含有共价键,故D错误.
故选:B.
点评 本题考查原子结构与元素周期律,推断元素是解题的关键,注意对元素周期律的理解掌握,B选项注意有机盐,难度中等.

练习册系列答案
相关题目
14.某同学将燃着的红磷放入装有氧气的集气瓶中燃烧,一段时间后,红磷熄灭,他立刻将燃烧匙取出,但此时红磷又开始燃烧.解释这种现象的说法错误的是( )
| A. | 红磷又接触到氧气 | |
| B. | 红磷的温度还高于它的着火点 | |
| C. | 燃烧时红磷转变成白磷,降低了着火点 | |
| D. | 瓶内的氧气不能耗尽红磷 |
11.一定条件下,在体积为10L的恒容密闭容器中,发生如下反应:2X(g)+Y(g)═Z (g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 以Y浓度变化表示的反应速率为0.005mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,X与Y的浓度相等 |
18.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
15.向纯水中加入少量的硫酸氢钠(溶液温度不变),则溶液的( )
| A. | pH值不变 | B. | pH值减小 | C. | 水的离子积增大 | D. | c(OH-)不变 |
12.对下列污染现象叙述正确的是( )
| A. | 臭氧空洞的形成主要与SO2有关 | |
| B. | 酸雨的形成主要与SO2有关 | |
| C. | 光化学烟雾的形成主要与NO2等有关 | |
| D. | 水体富营养化的形成主要与含氮、磷污水的排放有关 |
13.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 蛋白质、棉花、PVC、淀粉都是混合物 | |
| B. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
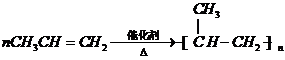 ,
, ,
,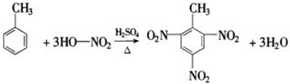 .
.