题目内容
14.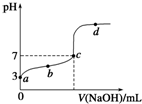 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
分析 A.根据酸的物质的量的浓度与PH间的关系判断,酸为弱酸,酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度;
B.Kw=c(H+)×c(OH-),Kw与温度有关;
C.根据弱酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性;
D.酸HA为弱酸,电离平衡常数只与温度有关,与其它任何条件都无关.
解答 解:A. 0.1mol/L 某一元酸HA溶液中,a点PH=3,则c(H+)=10-3mol/L,说明酸未完全电离为弱酸,酸能抑制水的电离,酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于酸根离子浓度,即c(A-)约为10-3 mol/L,故A错误;
B.某温度下,温度未知,所以Kw=c(H+)×c(OH-)不一定等于1×10-14,故B错误;
C.弱酸和氢氧化钠反应生成弱酸钠,弱酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D.b、d点时溶液的温度没有变化,所以b、d点表示的溶液中弱酸HA的电离平衡$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=K,值一定不变,故D正确;
故选D.
点评 本题考查酸碱混合溶液的定性判断,明确图象中各点的pH及弱电解质的电离影响因素即可解答,注意电离平衡常数只与温度有关,题目难度中等.

练习册系列答案
相关题目
4.在25℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出a mol气体,同时有w g Na2SO4•10H2O晶体析出.若温度不变,此时剩余溶液中溶质的质量分数为( )
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
5.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
2.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O下列有关说法正确的是( )
| A. | 储氢、释氢过程均无能量变化 | |
| B. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 | |
| C. | 上述储氢原理和钢瓶储氢原理相同 | |
| D. | NaHCO3含有离子键和共价键 |
18.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
 ,
, ,
, .
.