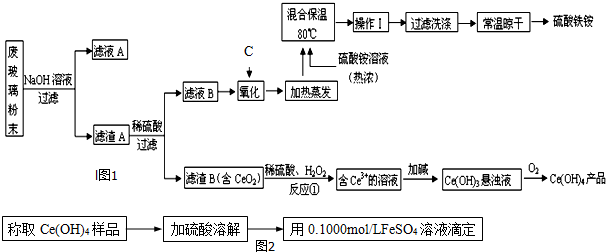
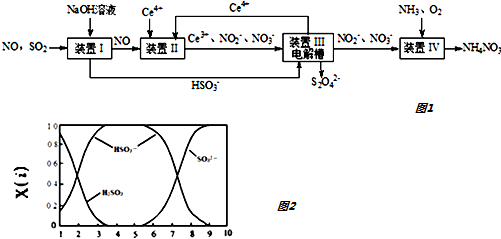
题目内容
12.三氯化氮(NCl3)常温是一种淡黄色液体,以下关于三氯化氮说法正确的是( )| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
分析 A.根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子采取SP3杂化,分子形状为三角锥形;
B.NCl3中N原子成3个N-Cl键,有1对孤对电子;
C.结构相似分子晶体中,其熔沸点与相对分子质量成正比;
D.水解中NCl3的负价原子结合水的正价原子,NCl3的正极原子结合水的负极基团.
解答 解:A.NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,分子形状为三角锥形,故A错误;
B.NCl3中N原子成3个N-Cl键,孤电子对个数=$\frac{5-3×1}{2}$=1,故B错误;
C.NCl3和PCl3结构相似,且都是分子晶体,NCl3的相对分子质量比PCl3的小,故其沸点比三氯化磷沸点低,故C正确;
D.NCl3中N元素为-3价,结合水的正价原子H,生成NH3,Cl元素为+1价,结合水的负价基团OH,生成HClO,故D错误;
故选C.
点评 本题以信息的形式考查NCl3分子空间结构、熔沸点、水解原理等知识,明确信息并结合所学知识即可解答,题目难度不大,D选项中产物判断为易错点,理解水解原理为关键.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
20.下列变化过程中,在常温下加入还原剂就能实现的是( )
| A. | Ag+→Ag | B. | CuO→Cu2+ | C. | SO2→SO3 | D. | CO→CO2 |
7.下列说法中,正确的是( )
| A. | 18O原子核内的中子数为8 | B. | 16O2和18O2的化学性质几乎相同 | ||
| C. | H216O与H218O质子数不同 | D. | H2和D2属于同位素 |
4.除去下列物质中含有的少量杂质(括号中的物质)的方法中错误的是( )
| A. | H2(HCl):通过水洗涤 | B. | NO(NH3):通过水洗涤 | ||
| C. | NH4Cl(NaCl):加热混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
1.下列化学式或名称一定表示一种纯净物的是( )
| A. | CH2F2 | B. | 油脂 | C. | C4H10 | D. | (C6H10O5)n |
2.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>③>④ | |
| B. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol•L-1盐酸、③0.1mol•L-1氯化镁溶液、④0.1mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| C. | 常温下将NaHSO3和NaHCO3两溶液混合后,溶液呈中性,则混合后的溶液中:c (Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |