题目内容
1.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )| A. | 100gKHCO3和CaCO3的混合物,含有的阳离子数目为NA | |
| B. | 常温常压下,1 mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 常温下,0.1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA |
分析 A、KHCO3和CaCO3的摩尔质量均为100g/mol,且均由1个阳离子和1个阴离子构成;
B、1mol甲醇燃烧消耗1.5mol氧气,而氧气反应后变为-2价;
C、求出丙烷的物质的量,然后根据丙烷中含10条共价键来分析;
D、铵根离子为弱碱阳离子,在溶液中会水解.
解答 解:A、KHCO3和CaCO3的摩尔质量均为100g/mol,故100gKHCO3和CaCO3的混合物的物质的量为1mol,且两者均由1个阳离子和1个阴离子构成,故1mol混合物中含阳离子为NA个,故A正确;
B、1mol甲醇燃烧消耗1.5mol氧气,而氧气反应后变为-2价,故1.5mol氧气转移6mol电子,个数为6NA个,故B正确;
C、标况下22.4L丙烷的物质的量为1mol,而丙烷中含10条共价键,故1mol丙烷中含10NA条共价键,故C正确;
D、铵根离子为弱碱阳离子,在溶液中会水解,故溶液中的铵根离子小于0.01NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.勒夏特列原理同样适用于电离平衡,请完成如表.
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
12.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成:其中○表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见下图),硅原子与氧原子的个数之比为( )
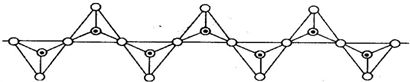

| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
9.下图是常用的化学仪器,其中常用于物质的分离与提纯的是( )
| A. |  | B. |  | C. |  | D. |  |
16. 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
6.32.5gZn投入到VmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
13.分子式为C6H12,分子结构中含有3个“CH3”原子团的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO42Na2O2+2SO3=2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
11.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O═3H++2Br-+SO42- |