题目内容
16. 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
分析 A、M-N间溶液的pH大于7,一定是氨水过量的情况,据此回答;
B、M点对应的溶液显示中性,酸碱恰好反应生成氯化铵显示酸性,应该是盐酸和氨水的混合物;
C、根据电荷守恒知识来判断;
D、根据溶液中的物料守恒来判断.
解答 解:A、M-N间溶液的pH大于7,一定是氨水过量的情况,存在c(NH4+)>c(Cl-)c(OH-)>c(H+),故A错误;
B、M点对应的溶液显示中性,是氯化铵和氨水的混合物,故B错误;
C、根据电荷守恒:pH=7溶液中有c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C错误;
D、P点处的溶液是等物质的量浓度的盐酸和氯化铵的混合物,存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-),故D正确.
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生实验操作、试剂选取、识图及分析判断能力,明确实验操作、盐类水解、弱电解质的电离等知识点是解本题关键,题目难度中等.

练习册系列答案
相关题目
7.下列判断错误的是( )
| A. | 常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L | |
| B. | 相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 | |
| C. | 标准状况下,44.8 L NO与22.4 L O2充分反应后得到的气体分子数小于2NA | |
| D. | 在常温常压下,2.24 L SO2与O2的混合气体中所含氧原子数为0.2NA |
4. 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )| A. | 惰性电极a为发生氧化反应 | |
| B. | Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解 | |
| C. | 溶液Y加热蒸发灼烧最终得到Fe2O3 | |
| D. | 电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑ |
11.下列物质的水溶液因水解而呈酸性的是( )
| A. | HCl | B. | NH4Cl | C. | CH3COONa | D. | NaHCO3 |
1.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 100gKHCO3和CaCO3的混合物,含有的阳离子数目为NA | |
| B. | 常温常压下,1 mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 常温下,0.1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA |
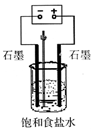 (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑