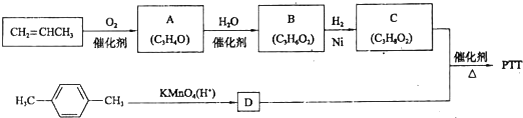
题目内容
12.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成:其中○表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见下图),硅原子与氧原子的个数之比为( )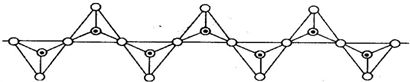
| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
分析 根据无限长单链的多聚硅酸根离子图可知,重复出现 ,以此来解答.
,以此来解答.
解答 解:由无限长单链的多聚硅酸根离子图可知,重复出现 ,
,
O表示氧原子,中心黑点表示硅原子,
则结构单元中硅原子个数为1,氧原子个数为2+2×$\frac{1}{2}$=3,
所以该阴离子中硅原子与氧原子的个数之比为1:3,
故选A.
点评 本题考查离子中原子的个数比,明确结构及重复出现的结构式解答本题的关键,注意O原子的共用是解答的难点和易错点,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
11.电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
(1)根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式H++HSO4-+Ba2++2OH-=BaSO4+2H2O
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
7.下列判断错误的是( )
| A. | 常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L | |
| B. | 相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 | |
| C. | 标准状况下,44.8 L NO与22.4 L O2充分反应后得到的气体分子数小于2NA | |
| D. | 在常温常压下,2.24 L SO2与O2的混合气体中所含氧原子数为0.2NA |
17.下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
| A. | 次氯酸钠水溶液具有强氧化性,故可用作消毒剂 | |
| B. | 氢氟酸能蚀刻玻璃,是利用氢氟酸的弱酸性 | |
| C. | 常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
4. 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )| A. | 惰性电极a为发生氧化反应 | |
| B. | Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解 | |
| C. | 溶液Y加热蒸发灼烧最终得到Fe2O3 | |
| D. | 电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑ |
1.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 100gKHCO3和CaCO3的混合物,含有的阳离子数目为NA | |
| B. | 常温常压下,1 mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 常温下,0.1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA |
2.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )


| A. | 试剂1可以选用石灰乳 | |
| B. | 从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=2 Cl-+Br2 | |
| C. | 工业上,电解熔融MgO冶炼金属镁可减小能耗 | |
| D. | 粗盐经提纯后可用于制备氯气、钠等产品 |