题目内容
5.NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )①标准状况下,2.24L Cl2中含有的共价键数
②常温下,2L pH=13的Na2CO3溶液中含有的OH-离子数
③100mL 1.0mo1•L-1的NaAlO2溶液中含有的氧原子数
④标准状况下,2.24L Cl2与足量的NaOH溶液反应时转移的电子数
⑤3.2gO2和O3的混合气体中含有的氧原子数
⑥3.9g Na2O2晶体中所含的离子总数.
| A. | ②③⑥ | B. | ②⑤ | C. | ③⑤⑥ | D. | ④⑥ |
分析 ①求出标准状况下,2.24L Cl2的物质的量,然后根据1mol氯气中含1mol共价键来分析;
②常温下,pH=13的Na2CO3溶液中含有的OH-的浓度为0.1mol/L,然后根据物质的量n=CV;
③100mL 1.0mo1•L-1的NaAlO2溶液中除了偏铝酸钠,水也含氧原子;
④求出标准状况下,2.24L Cl2的物质的量,然后根据氯气和氢氧化钠的反应为歧化反应来分析;
⑤O2和O3均由氧原子构成;
⑥求出3.9g Na2O2的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol阴离子构成.
解答 解:①标准状况下,2.24L Cl2的物质的量为0.1mol,而1mol氯气中含1mol共价键,故0.1mol氯气中含0.1mol共价键即0.1NA个,故①错误;
②常温下,pH=13的Na2CO3溶液中含有的OH-的浓度为0.1mol/L,故氢氧根的物质的量n=CV=0.1mol/L×2L=0.2mol,即0.2NA个,故②正确;
③100mL 1.0mo1•L-1的NaAlO2溶液中除了偏铝酸钠,水也含氧原子,故溶液中的氧原子的个数大于0.2NA个,故③错误;
④标准状况下,2.24L Cl2的物质的量为0.1mol,而氯气和氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,则0.1mol氯气转移0.1mol电子即0.1NA个,故④错误;
⑤O2和O3均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,个数为0.2NA个,故⑤正确;
⑥3.9g Na2O2的物质的量为0.05mol,而1mol过氧化钠中含2mol钠离子和1mol阴离子,故0.05mol过氧化钠中含0.15mol离子即0.15NA个,故⑥错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

| A. | 用蒸馏的方法分离水和油的混合物 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量泥沙 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Fe3+、Mg2+、SO42-、NO3- | D. | Cu2+、K+、NO3-、I- |
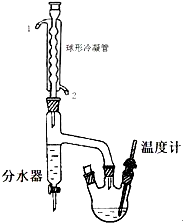 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
| A. | 加入BaCl2溶液生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- | |
| B. | 加入AgNO3溶液生成白色沉淀,则原溶液中一定含有Cl- | |
| C. | 加入KSCN溶液时,溶液不变红色,再滴入氯水溶液变为红色,则原溶液中一定含有Fe2+ | |
| D. | 加入盐酸,生成的气体能使成清石灰水变浑浊,则原溶液中一定含有CO32- |
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 乙醇溶液、臭氧、双氧水、高锰酸钾溶液均可用于消毒杀菌,且原理不同 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污 |
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗下口放出碘的苯溶液 | |
| D. | 常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA |
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
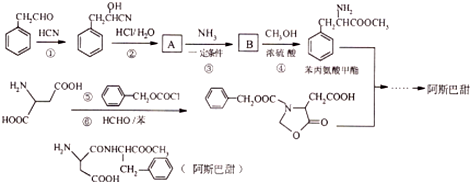
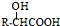 $→_{一定条件}^{NH_{3}}$
$→_{一定条件}^{NH_{3}}$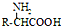
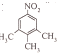 、
、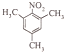 ;
;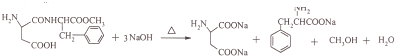 ;
;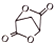 的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH:
的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH: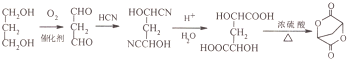 .
.