题目内容
10.关于某溶液中所含离子的检验,下列判断正确的是( )| A. | 加入BaCl2溶液生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- | |
| B. | 加入AgNO3溶液生成白色沉淀,则原溶液中一定含有Cl- | |
| C. | 加入KSCN溶液时,溶液不变红色,再滴入氯水溶液变为红色,则原溶液中一定含有Fe2+ | |
| D. | 加入盐酸,生成的气体能使成清石灰水变浑浊,则原溶液中一定含有CO32- |
分析 A.不能排除SO32-和Ag+的干扰;
B.Ag2SO4、Ag2CO3等都是白色沉淀,不能排除Ag2SO4、Ag2CO3等的存在;
C.亚铁离子容易被氧化剂氧化为三价铁离子,三价铁离子遇到硫氰化钾显示红色;
D.HSO3-、SO32-和盐酸反应生成的二氧化硫气体也可以使清石灰水变浑浊.
解答 解:A.SO32-能被硝酸氧化为SO42-,亚硫酸根离子存在可能生成不溶于硝酸的白色沉淀,并且不能排除Ag+的干扰,氯离子和银离子反应生成不溶于硝酸的氯化银白色沉淀,故A错误;
B.Ag2SO4、Ag2CO3等都是白色沉淀,加入AgNO3溶液生成白色沉淀,则原溶液中不一定含有Cl-,故B错误;
C.向某溶液中加入2滴KSCN溶液,溶液不显红色,一定不含有三价铁离子,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+,故C正确;
D.加入盐酸若有能使澄清石灰水变浑浊的气体生成,该气体可能为二氧化硫或二氧化碳,原溶液中可能含有SO32-、HCO3-、HSO3-等离子,不一定含有CO32-,故D错误;
故选C.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题侧重基础知识的考查,培养了学生得到灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作还原剂时,可能生成的产物是( )
| A. | N2 | B. | NO2 | C. | NO | D. | N2O3 |
1.某同学的实验报告中有如下数据,其中数据合理的是( )
| A. | 用托盘天平称取3.25g NaCl | |
| B. | 用酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用量筒量取10.51 mL盐酸 | |
| D. | 用容量瓶配制216mL 0.1mol/L NaOH溶液 |
18.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应 CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热 CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳 2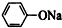 +CO2+H2O→2 +CO2+H2O→2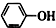 +Na2CO3 +Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
15.如图四种常见实验操作,正确的是( )
| A. |  固体的溶解 | B. |  流体的倾倒 | ||
| C. |  移走加热的蒸发皿 | D. |  读数 |
19.向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是
( )
| 操作 | 现象 | 结论 | |
| A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含Ag+ |
| B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO32- |
| C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl- |
| D | ①加KSCN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
20.在铜片上镀银时,下列叙述正确的是( )
| A. | 铜片接电源的正极 | |
| B. | 铜片上发生的反应是:Ag++e-═Ag | |
| C. | 银片上发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 需用硫酸铜溶液为电镀液 |
