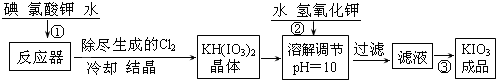
题目内容
13.200mL 0.5mol•L-1的盐酸与14.3g Na2CO3•xH2O恰好完全反应生成CO2,则x为( )| A. | 5 | B. | 6 | C. | 9 | D. | 10 |
分析 Na2CO3 •xH2O的物质的量为$\frac{14.3g}{(106+18x)g/mol}$,根据反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O可以计算出x的值.
解答 解:14.3g Na2CO3 •xH2O与20mL盐酸恰好完全反应生成正盐,反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,则
Na2CO3 •xH2O~2HCl
1 2
$\frac{14.3g}{(106+18x)g/mol}$ 0.2L×0.5mol/L
即2×$\frac{14.3g}{(106+18x)g/mol}$=0.2L×0.5mol/L,
解得x=10,
故选D.
点评 本题考查了有关物质的量浓度的计算、利用化学方程式的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度之间的转化关系.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
3.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
①a<54;②该反应的△S>0;③915℃、2.0MPa时E的转化率为60%;
④该反应△H<0;⑤K(1000℃)>K(810℃);
上述①~④中正确的有( )
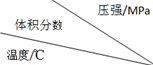 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
④该反应△H<0;⑤K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
4.将4molA气体和2molB气体在2L固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g).若经2s后测得C的物质的量为1.2mol,现有下列几种说法,其中正确的是( )
| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
1.将CH4和CO2两种最主要的温室气体重整也能获得CO和H2混合气.该反应中相关的化学键键能数据如下:
(1)写出CH4和CO2重整获得CO和H2的热化学方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=246kJ/mol.消耗1mol CO2时,转移电子的物质的量是6mol.
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
8.下列化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
18.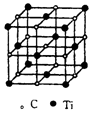 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )| A. | TiC | B. | Ti6C7 | C. | Ti14C13 | D. | Ti13C14 |
5.在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀,后沉淀溶解.这种溶液是( )
| A. | 稀硫酸 | B. | 饱和硫酸镁溶液 | C. | 饱和氯化钡溶液 | D. | 饱和硫酸铵溶液 |
2.化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是( )
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |