题目内容
6. 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
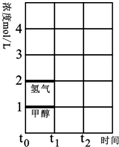
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
分析 (1)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②根据平衡浓度计算出平衡常数来确定温度;根据v=$\frac{△c}{△t}$计算反应速率;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动.
解答 解:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,所以是250℃;反应速率v(H2)=$\frac{1.6mol/L}{5min}$=0.32 mol•L-1•min-1,故答案为:250℃;0.32 mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至新平衡,图示如下:
假定在t2时刻后又达到新的平衡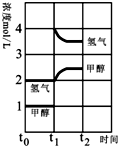 ;
;
故答案为:假定在t2时刻后又达到新的平衡 .
.
点评 本题考查了影响化学平衡移动的因素、速率的计算、热化学方程式盖斯定律应用等知识点,综合性强,难度大.

【查阅资料】

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
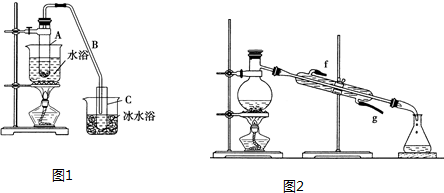
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.(图1)
(1)A中浓硫酸的作用是催化剂、脱水剂,将试管A置于水浴中的目的是冷却,防止环己烯挥发.
【精制粗产品】
(2)环己烯粗品中含有环己醇和少量酸性杂质等.加入c(填编号)洗涤,振荡、静置、分液,得到环己烯.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
(3)将环己烯用图2装置进行蒸馏,该装置中还缺少的玻璃仪器是温度计,加热蒸馏前要先加入生石灰的目的是除去水.
(4)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
| A. | NaHSO3溶液与NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+2OH-═CO32-+H2O | |
| C. | Ba(OH)2与H2SO4反应:H++OH-═H2O | |
| D. | 氨水和醋酸溶液混合:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O |
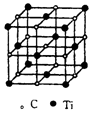 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )| A. | TiC | B. | Ti6C7 | C. | Ti14C13 | D. | Ti13C14 |
| A. | 用氯化钠溶液做导电实验,灯泡发光:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- | |
| B. | 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
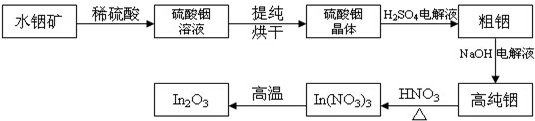
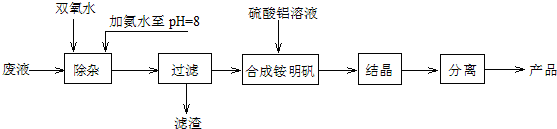
 .
.