题目内容
14.在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
分析 标准状况下,分子数相同的气体A和B,它们的物质的量相同,则相对分子质量之比、同体积的气体的体积之比均等于质量之比、分子数之比与物质的摩尔质量成反比,由ρ=$\frac{m}{V}$来分析密度之比,据此解答.
解答 解:A.标准状况下,Vm相同,由ρ=$\frac{m}{V}$可知,密度之比等于摩尔质量之比等于,即为a:b,故A正确;
B.A与B相对分子质量之比为a:b,同质量时由n=$\frac{m}{M}$可知,分子数之比等于$\frac{1}{a}$:$\frac{1}{b}$=b:a,故B正确;
C.由n=$\frac{m}{M}$可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag:bg=a:b,所以两种气体A与B的相对分子质量之比为a:b,故C错误;
D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a:b,故D正确;
故选:C.
点评 本题考查阿伏伽德罗定律及其推论,明确同温、同压、同体积,则气体的分子数相同、物质的量相同及质量、物质的量、摩尔质量的关系是解答的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.
5.下列叙述中正确的是( )
| A. | 纯碱(Na2CO3)从物质的分类看不属于碱 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 凡是能电离出H+的化合物均属于酸 | |
| D. | 盐类物质一定含有金属离子 |
2.下列说法不正确的是( )
| A. | 氯气可以和澄清石灰水反应制造漂白粉 | |
| B. | 金属钠可以用来冶炼某些金属 | |
| C. | 石灰石用于工业炼铁和玻璃制造 | |
| D. | 二氧化硅可以用于制作光学镜片,也可以制造光导纤维 |
9.制备(NH4)2Fe(SO4)2•6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理.室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
3.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
①a<54;②该反应的△S>0;③915℃、2.0MPa时E的转化率为60%;
④该反应△H<0;⑤K(1000℃)>K(810℃);
上述①~④中正确的有( )
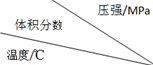 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
④该反应△H<0;⑤K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
20.将3molA与2.5molB混合起来,充入2L的密闭容器中,使之发生反应 3A(气)+B(气)?xC(气)+2D(气).经过5min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L•min).与此有关的以下叙述中错误的是( )
| A. | A的平均反应速率为0.15mol/(L•min) | B. | B的转化率为20% | ||
| C. | B的平衡浓度为0.5mol/L | D. | x的数值为2 |
1.将CH4和CO2两种最主要的温室气体重整也能获得CO和H2混合气.该反应中相关的化学键键能数据如下:
(1)写出CH4和CO2重整获得CO和H2的热化学方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=246kJ/mol.消耗1mol CO2时,转移电子的物质的量是6mol.
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.