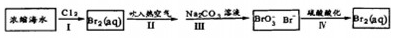题目内容
9.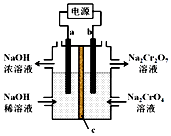 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )| A. | a连接电源负极 | |
| B. | b极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c为阳离子交换膜 | |
| D. | 通过2 mol电子时生成1 mol Cr2O72- |
分析 已知反应:2CrO42-+2H+?Cr2O72-+H2O,电解时阳极氢氧根离子失电子,同时生成氢离子,氢离子浓度增大,化学平衡向右移动,CrO42-生成Cr2O72-,阴极上氢离子失电子生成氢气,同时生成氢氧根离子,据此分析.
解答 解:A.阳极氢氧根离子失电子,同时生成氢离子,则b相连的电极为阳极,则b为正极,所以a为负极,故A正确;
B.b相连的电极为阳极,水中的氢氧根离子发生氧化反应,生成氧气,电极反应式为:2H2O-4e-=O2↑+4H+,故B正确;
C.与a相连的电极为阴极,阴极上氢离子失电子生成氢气,同时生成氢氧根离子,与右边流过来的钠离子结合成氢氧化钠而从左边溢出,所以c为阳离子交换膜,故C正确;
D.通过2 mol电子,产生2mol的氢离子,而2CrO42-+2H+?Cr2O72-+H2O是可逆反应,所以不可能完全转化,故D错误.
故选D.
点评 本题考查了电解原理的应用和化学平衡移动,题目难度中等,侧重于考查学生的分析能力,注意把握电极的判断方法以离子在溶液中的移动方向.

练习册系列答案
相关题目
18.表为元素周期表短周期的一部分,其中X元素的原子内层电子数是最外层电子数的一半.下列有关X、Y、Z、W、Q五种元素的叙述中,不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | X与Y形成的阴离子有XY32-、X2Y42- | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Q与Y可形成一种高效安全灭菌消毒剂 | |
| D. | W的最高价氧化物对应水化物的酸性比Q的弱 |
17.关于图示两个装置的说法正确的是( )
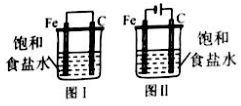

| A. | 两个装置中Fe棒上发生的反应相同 | |
| B. | 图 I中铁比图 II中铁腐蚀更快 | |
| C. | 两个装置中C棒上均明显有气体逸出 | |
| D. | 两个装置中Fe均是负极 |
4.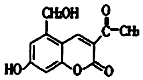 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
14.某化学兴趣小组设计了如图所示的电化学装置:下列说法不正确的是( )
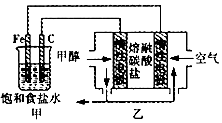

| A. | 乙池工作时,CO32-不断移向负极 | |
| B. | 乙池负极反应为CH3OH-6e-+3CO32-=4CO2+2H2O | |
| C. | 甲池中Fe电极发生的反应为2Cl--2e-=Cl2 | |
| D. | 为了使电池持续供电,工作时必须有CO2参与循环 |
1.下列装置能达到相应实验目的是( )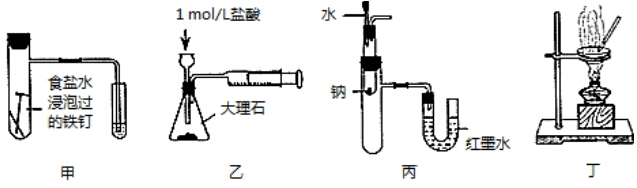

| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
17.短周期主族元素D、E、G、J的原子序数依次增大.D和J位于同主族,D和E的原子序数相差1,G的最高价氧化物对应的水化物既能与盐酸反应,又能与烧碱反应,J原子的电子总数等于最外层电子数的3倍.下列推断正确的是( )
| A. | 气态氢化物的热稳定性:E>d>J | |
| B. | 原子半径:G>E>J>D | |
| C. | 最高价氧化物对应水化物的酸性:J>D>G | |
| D. | E和J组成的化合物常作食品的干燥剂 |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 60g SiO2晶体含4NA个σ键 | |
| B. | 1mol[Cu(NH3)4]2+中含4NA配位键 | |
| C. | 在24g石墨中,含C-C共价键数目为6NA | |
| D. | CO和N2是等电子体,标况下22.4L的CO气体与1mol N2所含的电子数相等 |