题目内容
14.某化学兴趣小组设计了如图所示的电化学装置:下列说法不正确的是( )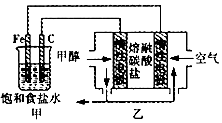
| A. | 乙池工作时,CO32-不断移向负极 | |
| B. | 乙池负极反应为CH3OH-6e-+3CO32-=4CO2+2H2O | |
| C. | 甲池中Fe电极发生的反应为2Cl--2e-=Cl2 | |
| D. | 为了使电池持续供电,工作时必须有CO2参与循环 |
分析 由乙池可知该燃料电池中,甲醇失电子和碳酸根离子反应生成二氧化碳和水,则甲醇所在电极为负极,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,氧气所在电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-=2CO32-,则甲池为电解池,与甲醇相连的C为阴极得电子发生还原反应,与氧气相连的铁为阳极失电子发生氧化反应,据此分析解答.
解答 解:A、由乙池可知该燃料电池中,甲醇失电子为负极,CO32-不断移向负极,故A正确;
B、由乙池可知该燃料电池中,甲醇失电子和碳酸根离子反应生成二氧化碳和水,则甲醇所在电极为负极,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,故B正确;
C、甲池为电解池,与氧气相连的铁为阳极失电子发生氧化反应,反应为Fe-2e-=Fe2+,故C错误;
D、乙中甲醇所在电极为负极,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,氧气所在电极为正极,电极反应式为O2+2CO2+4e-=2CO32-,所以为了使电池持续供电,工作时必须有CO2参与循环,故D正确.
故选:C.
点评 本题考查了原电池和电解池原理,明确充放电时各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液书写,为易错点.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
5.下列仪器名称正确的是( )
| A. |  三脚架 | B. |  溶量瓶 | C. |  镊子 | D. |  坩锅 |
2.X、Y、Z、W、R 为原子序数依次增大的五种短周期主族元素. X原子的最外层电子数是其内层电子数的2倍,W+与Y2- 具有相同的电子层结构,R 与 Y 可形成RY2、RY3化合物.下列说法正确的是( )
| A. | Y 与氢元素所形成的化合物分子只含有极性键 | |
| B. | W2Y、W2Y2 中阴、阳离子个数比均为 1:2 | |
| C. | Z 的最高价氧化物对应水化物的酸性比 R 的强 | |
| D. | 将XY2通入 W 单质与水反应后的溶液中,生成的盐只有一种 |
9.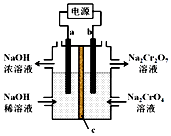 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )| A. | a连接电源负极 | |
| B. | b极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c为阳离子交换膜 | |
| D. | 通过2 mol电子时生成1 mol Cr2O72- |
19.下列有关糖类说法,错误的是 ( )
| A. | 葡萄糖和果糖分子式均为C6H12O6,均属于还原糖 | |
| B. | 淀粉和纤维素都属于多糖,其中每个葡萄糖单元包含三个羟基 | |
| C. | 糖类并不是都有甜味,有甜味的物质也不一定是糖类 | |
| D. | 葡萄糖具有多羟基醛的结构,属于最简单的单糖 |
5.常温下,pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液中水的电离程度大小关系是( )
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法判断 |
2.常温下,下列说法不正确的是( )
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 相同pH 的 CH3COONa、NaOH 和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| C. | 0.1mol/LNaHA 溶液 pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) | |
| D. | 已知H2CO3的电离常数K1=4.4×10-7、K2=4.7×10-11,HClO的电离常数K=2.9×10-8,若向新制氯水中加入足量Na2CO3固体,则c(HClO)增大 |
1.春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体来洗涤丝帛.这种液体能洗涤丝帛主要是因为其中含有( )
| A. | 氧化钙 | B. | 碳酸钠 | C. | 氢氧化钾 | D. | 次氯酸钠 |
