题目内容
8.短周期元素A、B、C、D的原子序数依次增大,A、B同主族,A核外电子数等于其电子层数,C为元素周期表中原子半径最小的金属元素,D最外层电子数是其电子层数的3倍.(1)微粒半径比较:A->B+
(2)A与D能组成化合物A2D和A2D2.A2D的沸点比D同主族中其他元素与A组成的化合物的沸点高,原因是H2O分子间除范德华力外,还能形成氢键;A2D2电子式
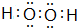
(3)已知:
Ⅰ.3Mg+N2=Mg3N2
Ⅱ.在元素周期表中,有些元素的化学性质与其相邻左上方或右下方的另一主族元素的化学性质相似.
①C构成的单质能(填“能”或“不能”)与强碱溶液反应.
②B构成的单质在空气中充分燃烧的产物可能是Li3N、Li2O(填两种即可)
分析 短周期元素A、B、C、D的原子序数依次增大,A核外电子数等于其电子层数,则A为H元素;C为元素周期表中原子半径最小的金属元素,则C为Be;D最外层电子数是其电子层数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;A、B同主族,B的原子序数小于Be,则B为Li.
解答 解:短周期元素A、B、C、D的原子序数依次增大,A核外电子数等于其电子层数,则A为H元素;C为元素周期表中原子半径最小的金属元素,则C为Be;D最外层电子数是其电子层数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;A、B同主族,B的原子序数小于Be,则B为Li.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,微粒半径比较:H->Li+,故答案为:>;
(2)H2O分子间除范德华力外,还能形成氢键,H2O的沸点比同主族中其他元素氢化物的沸点高,H2O2电子式 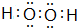 ,
,
故答案为:H2O分子间除范德华力外,还能形成氢键;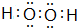 ;
;
(3)①C为Be,与Al的性质相似,Be单质能与强碱溶液反应,故答案为:能;
②B为Li,在空气中充分燃烧的产物可能是:Li3N、Li2O等,故答案为:Li3N、Li2O等.
点评 本题考查结构性质位置关系综合运用,熟练元素周期表结构与掌握元素周期律,侧重考查相似分析推理与知识迁移运用能力.

练习册系列答案
相关题目
3.用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
20.在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
17.标准状况下1mol烃完全燃烧时,生成89.6L CO2,又知0.1mol此烃能与标准状况下4.48L H2加成,则此烃的结构简式是( )
| A. | CH3CH2CH2CH3 | B. | CH3-C≡C-CH3 | ||
| C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH-CH3 |
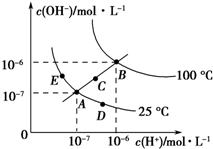 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:
 ,C
,C .
.