题目内容
(1)0.5molN2的质量是 ,在标准状况下所占的体积约为 ,所含的原子数目约为 .
(2)同温同压下,同体积的O2和O3,分子数之比为 ,质量之比为 ,密度之比为 .
(3)12.4g Na2X中含有0.4mol Na+,则Na2X的摩尔质量是 ,X的相对原子质量是 .
(2)同温同压下,同体积的O2和O3,分子数之比为
(3)12.4g Na2X中含有0.4mol Na+,则Na2X的摩尔质量是
考点:物质的量的相关计算
专题:计算题
分析:(1)根据m=n?M,V=n?Vm,N=n?NA计算;
(2)同温同压下,气体摩尔体积相同,N=
×NA、m=
×M及ρ=
计算;
(3)根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量.
(2)同温同压下,气体摩尔体积相同,N=
| V |
| V m |
| V |
| Vm |
| M |
| Vm |
(3)根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量.
解答:
解:(1)m=n?M=0.5mol×28g/mol=14g,V=n?Vm=0.5mol×22.4L/mol=11.2L,N=n?NA=0.5mol×6.02×1023mol-1=6.02×1023,
故答案为:14g;11.2L; 6.02×1023;
(2)温同压下,气体摩尔体积相同,根据N=
×NA可知,等体积的O2和O3所含分子个数比是1:1,根据m=
×M可知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3,根据ρ=
可知密度之比等于摩尔质量之比=2:3,
故答案为:1:1;2:3;2:3;
(3)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=
n(Na+)=0.4mol×
=0.2mol,
Na2X的摩尔质量为:M(Na2X)=
=62g/mol,即Na2X的相对原子量为62,
X的相对原子质量为:62-23×2=16,
故答案为:62g/mol;16.
故答案为:14g;11.2L; 6.02×1023;
(2)温同压下,气体摩尔体积相同,根据N=
| V |
| V m |
| V |
| Vm |
| M |
| Vm |
故答案为:1:1;2:3;2:3;
(3)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=
| 1 |
| 2 |
| 1 |
| 2 |
Na2X的摩尔质量为:M(Na2X)=
| 12.4g |
| 0.2mol |
X的相对原子质量为:62-23×2=16,
故答案为:62g/mol;16.
点评:本题考查物质的量的有关计算、阿伏伽德罗定律及其推论,灵活运用公式是解本题的关键,有关气体体积的计算要注意温度和压强,为易错点.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
假定把12C的相对原子质量改为24 (NA代表阿伏加德罗常数 ) 则下列推断中不正确的是( )
| A、此时氧原子的相对原子质量为32 |
| B、此时氧气的摩尔质量为64 g/mol,标准状况下44g 的CO2的体积为44.8 L |
| C、NA个氧分子与NA个氢分子的质量比为16:1 |
| D、44 g CO2和28gCO含有相同数目的分子 |
下列说法中,正确的是( )
| A、HNO3和Cu(OH)2都是电解质 |
| B、BaSO4难溶于水,是弱电解质 |
| C、盐酸的导电能力一定比H2CO3溶液的强 |
| D、CO2溶于水所得溶液能导电,CO2是电解质 |
下列说法中,正确的是( )
| A、所有元素在自然界中都存在化合态和游离态 |
| B、在水溶液中能电离出H+的化合物都是酸 |
| C、非金属氧化物都是酸性氧化物 |
| D、根据组成元素可把氧化物分成金属氧化物和非金属氧化物 |
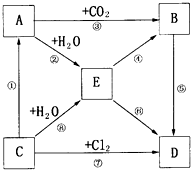 如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.