题目内容
15.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中属于区域3的是( )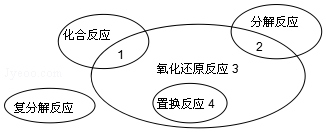
| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
分析 由图可知,区域3属于氧化还原反应,但不属于置换反应,也不属于化合反应和分解反应,有元素化合价变化的反应为氧化还原反应,单质与化合物反应生成单质与化合物的反应为置换反应,以此来解答.
解答 解:A.O元素的化合价变化,属于氧化还原反应,但不属于置换反应,也不属于化合反应和分解反应,故A选;
B.属于置换反应,也属于氧化还原反应,故B不选;
C.Fe、O元素的化合价变化,属于氧化还原反应,但也属于化合反应,故C不选;
D.属于分解反应,且元素的化合价没有变化,不属于氧化还原反应,故D不选;
故选A.
点评 本题考查氧化还原反应及四种基本反应类型,明确反应的分类及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 45g水中含有的水分子数是2.5NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L、0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 1molCH4含电子数目为8NA |
6.某无色透明溶液,在酸性环境下能大量共存的离子组是( )
| A. | CH3COO-、Cl-、NH4+、SO42- | B. | Mg2+、Cl-、Na+、NO3- | ||
| C. | K+、MnO4-、NO3-、Fe2+ | D. | Na+、SO42-、HCO3-、Cl- |
3.干冰是( )
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ③④⑤ |
10.在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,则与5molCr3+反应所需PbO2的物质的量为( )
| A. | 7.5mol | B. | 1.5mol | C. | 3mol | D. | 3.25mol |
1. 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )| A. | Ag2CO3的Ksp为8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=2.5×108 | |
| C. | 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |