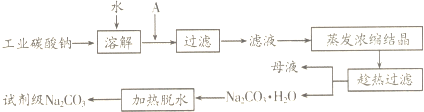
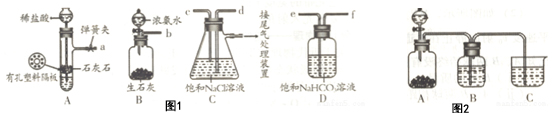
题目内容
20.实验室用CaCO3与稀盐酸反应制取CO2气体.若制备标况下11.2LCO2气体,(1)需要消耗0.5mol/L的盐酸的体积为多少mL?
(2)消耗含杂质5%的石灰石的质量是多少g(假设杂质不与盐酸反应)?
分析 根据二氧化碳的体积,利用化学方程式,列出比例式进行求解消耗0.5mol/L的盐酸的体积和碳酸钙的质量,然后利用质量分数求出石灰石的质量.
解答 解:设参加反应的碳酸钙的质量为xg,消耗0.5mol/L的盐酸的体积为yL,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 2mol 22.4L
5%x 0.5ymol 11.2L
所以有$\frac{100}{5%x}$=$\frac{2}{0.5y}$=$\frac{22.4}{11.2}$,解得:x=1000g,y=2L=2000mL;
故答案为:(1)需要消耗0.5mol/L的盐酸的体积为2000mL;
(2)消耗含杂质5%的石灰石的质量是1000g.
点评 本题是考查学生利用化学方程式进行简单计算的能力,思路比较简单,解题得分的关键是步骤必须规范.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.下列在给定状态下能导电的是( )
| A. | 固体氯化钠 | B. | 液态氯化氢 | C. | 乙醇溶液 | D. | 液态氢氧化钾 |
11.下列说法中正确的是( )
| A. | 在电解池中,物质在阴极发生氧化反应 | |
| B. | 在电解池中,与电源正极相连的电极是阴极 | |
| C. | 在原电池中,物质在负极发生氧化反应 | |
| D. | 在原电池中,电子由正极流向负极 |
8.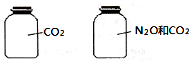 如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )
如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )
 如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )
如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )| A. | 所含氧原子数相等 | B. | 气体的总质量相等 | ||
| C. | 气体所含电子总数相等 | D. | 气体的密度相等 |
15.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中属于区域3的是( )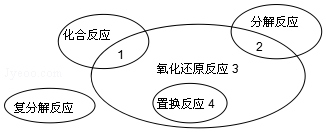

| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
9.已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是( )
| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
6.已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
| A. | 相同温度时,两种饱和溶液中:c(Cl-)≈1.9c(Br-) | |
| B. | AgCl、AgBr组成的混合溶液中:c(Cl-)>c(Br-) | |
| C. | 向饱和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大 | |
| D. | AgBr在水中溶解度及Ksp均比在NaBr溶液中的大 |
7.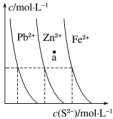 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )| A. | 三种难溶物的溶度积Ksp(FeS)的最小 | |
| B. | 如果向三种沉淀中加盐酸,最先溶解的是PbS | |
| C. | 向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀 | |
| D. | 对于三种难溶物来讲,a点对应的都是不饱和溶液 |