题目内容
6.某无色透明溶液,在酸性环境下能大量共存的离子组是( )| A. | CH3COO-、Cl-、NH4+、SO42- | B. | Mg2+、Cl-、Na+、NO3- | ||
| C. | K+、MnO4-、NO3-、Fe2+ | D. | Na+、SO42-、HCO3-、Cl- |
分析 强酸性溶液,含大量的H+,根据离子之间不能结合生成水、气体、沉淀,不能发生氧化 还原反应等,则离子能大量共存,并结合离子的颜色来解答.
解答 解:A.酸性条件下CH3COO-不能大量共存,故A错误;
B.因该组离子之间不反应,能大量共存,且离子均为无色,故B正确;
C.MnO4-、Fe2+有颜色,不符合题目无色要求,且酸性条件下发生氧化还原反应,故C错误;
D.因H+、HCO3-结合生成水和气体,不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存问题,为高考高频考点,侧重复分解反应的考查,注意离子之间的反应及常见离子的颜色,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
17.下列说法正确的是( )
| A. | 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+ | |
| B. | 实验中要配制500mL0.2mol•L-1KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,证明NH4Cl固体易升华 | |
| D. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 |
14.属于氧化还原反应的离子方程式的是( )
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
1.最简式相同,既不是同系物,又不是同分异构体的是( )
| A. | 乙烯和1-丁烯 | B. | 苯和乙炔 | ||
| C. | 正丁烷和2-甲基丙烷 | D. | 甲苯和乙苯 |
11.下列说法中正确的是( )
| A. | 在电解池中,物质在阴极发生氧化反应 | |
| B. | 在电解池中,与电源正极相连的电极是阴极 | |
| C. | 在原电池中,物质在负极发生氧化反应 | |
| D. | 在原电池中,电子由正极流向负极 |
18.下列叙述正确的是( )
| A. | 酸性氧化物不一定都是非金属氧化物 | |
| B. | HCl、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
15.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中属于区域3的是( )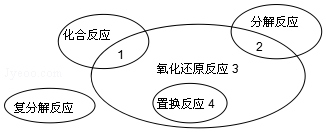

| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.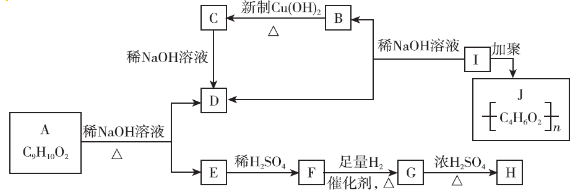
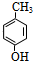 .
.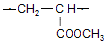 .
.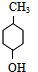 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$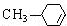 +H2O.
+H2O. .
.