题目内容
15.下列装置所示的实验中,能达到目的是( )| A. |  长时间看到Fe(OH)2白色沉淀 | B. |  除去Cl2中的HCl杂质 | ||
| C. |  比较NaHCO3、Na2CO3的热稳定性 | D. |  分离碘酒中的碘和酒精 |
分析 A.若要较长时间看到Fe(OH)2白色沉淀,制备实验装置应排出空气,防止氢氧化亚铁被氧化;
B.洗气时,加入洗气瓶的导管应该采用长进短出的方式;
C.碳酸氢钠不稳定,在小试管中,而碳酸钠不分解;
D.酒精与水互溶,混合液不分层,无法通过分液分离.
解答 解:A.Fe与稀硫酸反应生成的氢气将装置内空气排出,可防止生成的氢氧化亚铁被氧化,能够达到实验目的,故A正确;
B.图示装置无法达到洗气目的,插入集气瓶中的导管应该采用长进短出的方式,故B错误;
C.碳酸氢钠不稳定,在小试管中,而碳酸钠不分解,图中装置可比较稳定性,故C正确;
D.酒精与水相互溶解,不能选用酒精作萃取剂,可用四氯化碳或苯,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,题目难度中等,把握氢氧化亚铁制备、混合物分离提纯、稳定性比较、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.设NA表示阿伏伽德罗常数的数值,下列说法错误的是( )
| A. | 常温常压下,1 mol氦气含有的核外电子数为2NA | |
| B. | 1.7gCH5+离子中含有的电子总数为NA | |
| C. | lmolC10H22分子中共价键总数为31 NA | |
| D. | lmolNO2与足量水反应时共转移2NA个电子 |
6.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br- | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-、Al(OH)3 |
3.下列说法正确的是( )
| A. | 电解精炼粗铜时,粗铜应作阴极 | |
| B. | 氯碱工业的阳极区得到的产品是H2和NaOH | |
| C. | 将金属与直流电源的负极相连的方法叫做外加电流的阴极保护法 | |
| D. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快 |
10.高温及一定催化剂作用下某反应达平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,恒容时,温度升高,H2浓度减小.下列说法:正确的是( )
| A. | 平衡后向容器中再充入与初始投料相同物质的量的CO2和H2,则CO的平衡浓度变为原来的2倍 | |
| B. | 恒温恒容下,增大压强,H2的浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为:CO2(g)+H2(g)?CO(g)+H2O(g)△H<0 |
20.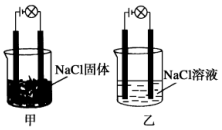 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
( )
 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
| A. | NaCl溶液是电解质 | |
| B. | 在通电的条件下,NaCl在水中电离出大量的离子而导电 | |
| C. | NaCl固体中无阴阳离子,因此不能导电 | |
| D. | 同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强 |
7.化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
4.制取水处理剂C1O2(其部分性质如下表所示)的方法之一是利用草酸(H2C2O4)与氯酸钾反应,反应的化学方程式为2KC1O3+aH2C2O4+H2SO4=2C1O2↑+K2SO4+2CO2↑+bH2O.下列有关该反应的说法不正确的是( )
| 熔点/℃ | 沸点/℃ | 水溶性 |
| -59.5 | 11.0 | 极易溶解 |
| A. | 化学方程式中的a=l,b=2 | |
| B. | 草酸起到还原剂的作用 | |
| C. | KC1O3中只有Cl元素被还原 | |
| D. | 在标准状况下生成5.6L C1O2,转移0.2mol电子 |
5.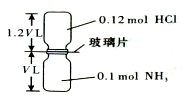 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |