题目内容
7.化学与环境、材料、信息、能源关系密切,下列说法错误的是( )| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
分析 A.二氧化硅与碳反应生成硅与一氧化碳;
B.依据三价铁离子水解生成具有吸附性氢氧化铁胶体解答;
C.拦阻索是特种钢缆,为钢丝绳;
D.烟花爆竹的燃放能够产生大量粉尘;
解答 解:A.沙子主要成分为二氧化硅,二氧化硅与碳反应生成硅与一氧化碳,硅为良好的半导体材料,可以用于制造计算机芯片,故A错误;
B.硫酸铁易溶于水,电离产生的铁离子水解生成具有吸附性氢氧化铁胶体,可以吸附水中固体杂质颗粒,所以可作净水剂,故B正确;
C.拦阻索是特种钢缆,为钢丝绳,主要成分为Fe,属于金属材料,故C正确;
D.烟花爆竹的燃放能够产生大量粉尘,减少烟花爆竹的燃放,可以减少粉尘的排放,有利于降低空气中的PM2.5含量,故D正确;
故选:A.
点评 本题考查较综合,设计物质的性质与用途、材料的分类、环境污染与治理,明确盐类水解的性质及应用,熟悉常见物质的成分及性质是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
17.如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是.( )


| A. | 若关闭 K2、打开 K1,一段时间后,发现左侧试管收集到的气体比右侧略多 则 a 为正极,b 为负极 | |
| B. | 关闭 K2,打开 K1,一段时间后,用拇指堵住试管移出烧 杯,向试管内滴 入酚酞,发现左侧试管内溶液变红色,则 a 为负极,b 为正极 | |
| C. | 若直流电源 a 为负极,b 为正极,关闭 K2 ,打开 K1,一段时间后,再关闭 K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 | |
| D. | 若直流电源 a 为负极,b 为正极,关闭 K2,打开 K1,一段时间后,再关闭 K1,打开 K2,则左 侧石墨棒上发生的电极反应为 H2-2e-+2OH-═2H2O |
18.下列对某些问题的认识正确的是( )
| A. | 漂白粉和明矾都常用于自来水的处理,且二者的作用原理相同 | |
| B. | Na的还原性比Cu强,故可用Na与CuSO4溶液反应制取Cu | |
| C. | 不能用带玻璃塞的玻璃瓶盛放碱液 | |
| D. | 玻璃、水泥、陶瓷、水晶都是重要的硅酸盐材料 |
15.下列装置所示的实验中,能达到目的是( )
| A. |  长时间看到Fe(OH)2白色沉淀 | B. |  除去Cl2中的HCl杂质 | ||
| C. |  比较NaHCO3、Na2CO3的热稳定性 | D. |  分离碘酒中的碘和酒精 |
2.下列实验现象的描述,正确的是( )
| A. | 氧化铁溶于水生成红褐色沉淀 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| D. | 铜在氯气中燃烧,产生棕黄色烟 |
12.分子式为C5H8O2的有机物,能使溴水褪色,也能与饱和NaHCO3溶液反应,则该有机物的结构(不考虑立体异构)有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
19.关于CH4说法错误的是( )
| A. | 固态时属于分子晶体 | B. | 正四面体结构的分子 | ||
| C. | 与CCl4结构相似、分子间存在氢键 | D. | 含极性键的非极性分子 |
12.乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol.
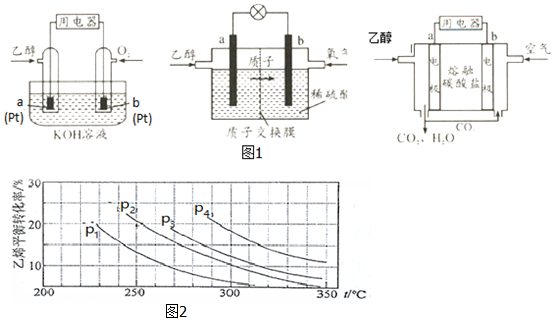
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣.现有以下三种乙醇燃料电池(图1).碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为O2.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为C2H5OH+16OH--12e-2CO32-+11H2O,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为3O2+12H++12e-6H2O,通过质子交换膜的离子是H+.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极a(填“a”或“b”)移动,电极b上发生的电极反应式为O2+2CO2+4e-2CO32-.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)?CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是:反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去、增加nH2O:nC2H4比.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是检验反应后溶液中是否还含有溴单质.
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应.
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):取含amolBr2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=amol则发生取代反应;若n(Br-)=2amol则发生氧化反应;若amol<n(Br-)<2amol则既发生了取代反应也发生了氧化反应.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol.
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(1)三种乙醇燃料电池中正极反应物均为O2.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为C2H5OH+16OH--12e-2CO32-+11H2O,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为3O2+12H++12e-6H2O,通过质子交换膜的离子是H+.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极a(填“a”或“b”)移动,电极b上发生的电极反应式为O2+2CO2+4e-2CO32-.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)?CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是:反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去、增加nH2O:nC2H4比.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应.
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):取含amolBr2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=amol则发生取代反应;若n(Br-)=2amol则发生氧化反应;若amol<n(Br-)<2amol则既发生了取代反应也发生了氧化反应.
